
| A. | 等于13.5% | B. | 大于12.5% | C. | 小于12.5% | D. | 无法确定 |
分析 设浓氨水的体积为V,稀释前后溶液中溶质的质量不变,氨水的密度小于水的密度,浓度越大密度越小,稀释后得到氨水的密度应大于0.910g•cm-3,据此进行解答.
解答 解:设加水的体积为V,则27%的氨水体积也为V,该氨水用等体积的水稀释后,所得氨水的质量分数为$\frac{V×0.910g/cm{\;}^{-3}×25.0%}{V×0.910g/cm{\;}^{-3}+V×1g/mL}$×100%≈11.9%<12.5%;
故选:C.
点评 本题考查了溶液稀释后质量分数计算,题目难度中等,抓住溶液稀释前后溶质的质量不变,明确氨水密度小于水是解题关键,试题培养了学生的化学计算能力.


 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:解答题
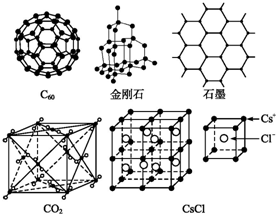
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )| A. | 等物质的量的两种物质跟足量的NaOH反应,消耗NaOH的量相等 | |
| B. | 完全燃烧等物质的量的两种物质生成二氧化碳和水的量分别相等 | |
| C. | 一定条件下,两种物质都能发生酯化反应和氧化反应 | |
| D. | 鞣酸分子中,可能在同一平面上的原子最多有14个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
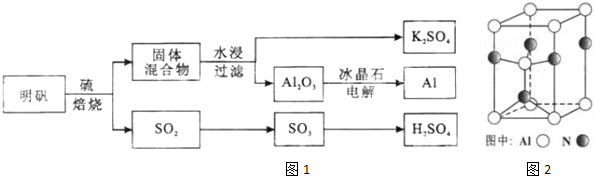
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 粒子 | 键长(1.0×10-10m) | 键能(kJ•mol-1) |
| O22- | 1.49 | a |
| O2- | 1.28 | b |
| O2 | 1.21 | c=494 |
| O2+ | 1.12 | d=628 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com