

 ,则符合下列条件F的同分异构体有
,则符合下列条件F的同分异构体有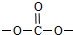 结构.
结构. ,由转化关系可知B为
,由转化关系可知B为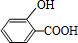 ,C的分子式为C5H12O,C能与金属Na反应,属于饱和一元醇,C的一氯代物有2种,分子中有2种H原子,故C的结构简式是
,C的分子式为C5H12O,C能与金属Na反应,属于饱和一元醇,C的一氯代物有2种,分子中有2种H原子,故C的结构简式是 ,B与C发生酯化反应生成M为
,B与C发生酯化反应生成M为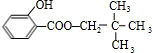 ,苯酚与丙酮反应生成D,D的分子式为C15H16O2,再结合N的结构可知D为
,苯酚与丙酮反应生成D,D的分子式为C15H16O2,再结合N的结构可知D为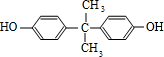 ,据此解答;
,据此解答;| 122×26.23% |
| 16 |
| 90 |
| 12 |
 ,则符合下列条件F的同分异构体:①能发生银镜反应,含有醛基或甲酸形成的酯基,②能与NaHCO3溶液反应,含有羧基,③分子中有苯环,无
,则符合下列条件F的同分异构体:①能发生银镜反应,含有醛基或甲酸形成的酯基,②能与NaHCO3溶液反应,含有羧基,③分子中有苯环,无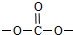 ,侧链可以为-COOH、-OOCH,有邻、间、对三种位置,侧链可以为-COOH、-OH、-CHO,结合定二移一法确定同分异构体数目.
,侧链可以为-COOH、-OOCH,有邻、间、对三种位置,侧链可以为-COOH、-OH、-CHO,结合定二移一法确定同分异构体数目. ,由转化关系可知B为
,由转化关系可知B为 ,C的分子式为C5H12O,C能与金属Na反应,属于饱和一元醇,C的一氯代物有2种,分子中有2种H原子,故C的结构简式是
,C的分子式为C5H12O,C能与金属Na反应,属于饱和一元醇,C的一氯代物有2种,分子中有2种H原子,故C的结构简式是 ,B与C发生酯化反应生成M为
,B与C发生酯化反应生成M为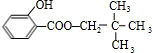 ,苯酚与丙酮反应生成D,D的分子式为C15H16O2,再结合N的结构可知D为
,苯酚与丙酮反应生成D,D的分子式为C15H16O2,再结合N的结构可知D为 ,
, ,含有的官能团有:羧基、羟基,故答案为:石炭酸;羧基、羟基;
,含有的官能团有:羧基、羟基,故答案为:石炭酸;羧基、羟基; ,
, ;
;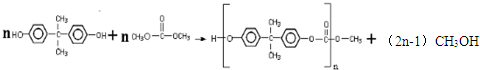 ,
, ;
;| 122×26.23% |
| 16 |
| 90 |
| 12 |
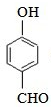 ,故答案为:
,故答案为: ;
; ,则符合下列条件F的同分异构体:①能发生银镜反应,含有醛基或甲酸形成的酯基,②能与NaHCO3溶液反应,含有羧基,③分子中有苯环,无
,则符合下列条件F的同分异构体:①能发生银镜反应,含有醛基或甲酸形成的酯基,②能与NaHCO3溶液反应,含有羧基,③分子中有苯环,无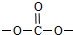 ,侧链可以为-COOH、-OOCH,有邻、间、对三种位置,侧链可以为-COOH、-OH、-CHO,-COOH、-OH有邻、间、对三种位置,当-COOH、-OH处于邻位,-CHO有4种位置,当-COOH、-OH处于间位,-CHO有4种位置,当-COOH、-OH处于对位,-CHO有2种位置,故符合条件的同分异构体有:3+4+4+2=13种,故答案为:13.
,侧链可以为-COOH、-OOCH,有邻、间、对三种位置,侧链可以为-COOH、-OH、-CHO,-COOH、-OH有邻、间、对三种位置,当-COOH、-OH处于邻位,-CHO有4种位置,当-COOH、-OH处于间位,-CHO有4种位置,当-COOH、-OH处于对位,-CHO有2种位置,故符合条件的同分异构体有:3+4+4+2=13种,故答案为:13.


科目:高中化学 来源: 题型:
| A、小苏打溶液中加入少量的澄清石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| B、磁性氧化铁在盐酸中长期浸泡:Fe3O4+8H+=2Fe3++Fe2++4H2O |
| C、向Ca(ClO)2溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO |
| D、向FeO中加入足量稀硝酸:FeO+2H+=2Fe2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应需25秒达平衡,反应达平衡以E表示反应速率为0.01mol/(L?s) |
| B、若维持其它条件不变,向上述容器中起初加入2.0molM,反应建立平衡,M的转化率为50% |
| C、若维持其它条件不变,再向上述反应平衡中分别加入0.5molE,0.5molM,则平衡向右移动 |
| D、若上述容器为绝热容器,则反应达平衡速率比原平衡速率增大,M浓度也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体的物质的量不再变化 |
| B、v(A):v(B):v(C)=1:2:2 |
| C、C生成的速率与C分解的速率相等 |
| D、单位时间内消耗amolA,同时生成2amolC |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用加热的方法除去碳酸钠中的碳酸氢钠 |
| B、用蒸馏的方法除去溴水中的Br2 |
| C、向Na2SO3溶液中加入HCl酸化的Ba(NO3)2以检验Na2SO3是否变质 |
| D、将乙醇、浓硫酸混合共热至170℃,将产物通入到酸性KMnO4溶液中检验乙烯的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,pH=1的盐酸中:Na+、Fe3+、NO3-、SO42- |
| B、强碱性溶液中:K+、Mg2+、Cl-、SO42- |
| C、含有Ca2+的溶液中:Na+、K+、CO32-、Cl- |
| D、由水电离产生的c(H+)=1×10-13mol/L的溶液中:Na+、K+、SiO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com