
【题目】现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥E、C同主族,且E比C多两个电子层,E单质可与冷水反应生成氢气.
试回答:
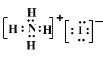
(1)A在元素周期表中的位置___,B的离子结构示意图___,化合物NH4D(含D-的铵盐)的电子式___。
(2)C的某种简单阳离子,其原子核中含22个中子,其化学符号为___;元素D最高价氧化物的水化物化学式为___。
(3)B、C、E三种元素的金属性按照由强到弱的顺序排列应为:___(用元素符号表示)。
(4)写出单质B和氢氧化钠溶液反应的离子方程式:___。
(5)写出E与冷水反应的离子方程式:___。
【答案】第二周期第ⅥA族 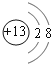
![]() K+ HIO4 Cs>K>Al 2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Cs+2H2O=2Cs++2OH-+H2↑
K+ HIO4 Cs>K>Al 2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Cs+2H2O=2Cs++2OH-+H2↑
【解析】
A、B、C、D、E五种元素它们的质子数依次增多,①A的核电荷数大于2可形成氢化物H2A该氢化物在常温下是液体则A为氧元素;②A和B两元素可形成B2A3化合物该化合物既能溶于强酸又能溶于强碱则B为铝元素;③B为铝元素,C+离子比B3+离子多8个电子则C为钾元素;④C与D元素可以形成化合物CD;⑤CD的溶液中通入氯气后加淀粉溶液显蓝色,则D为碘元素;⑥C为钾元素在周期表中E处于C的下两个周期E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1则E为+1价金属与钾元素同主族,则E为Cs元素,据此分析解答。
(1)根据上述分析可知,A为O元素,是第8号元素,位于元素周期表的第二周期第ⅥA族,B为Al元素,核电荷数为13,其离子结构示意图为 ,D为I元素,化合物NH4I为离子化合物,电子式为
,D为I元素,化合物NH4I为离子化合物,电子式为 ,故答案为:第二周期第ⅥA族;
,故答案为:第二周期第ⅥA族; ;
; ;
;
(2)C为K元素,质子数为19,根据质量数=质子数+中子数可知,K的某种简单阳离子,其原子核中含22个中子,其化学符号为![]() K+,故答案为:
K+,故答案为:![]() K+;
K+;
(3)同一周期元素金属性从左至右依次减弱,则金属性:Na>Al,同一主族元素金属性至上而下金属性依次增强,则金属性:Cs>K>Na,因此金属性:Cs>K>Al,故答案为:Cs>K>Al;
(4)B为Al元素,Al单质具有两性,与氢氧化钠溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)Cs还原性很强,可将冷水中的氢还原为氢气,其离子反应方程式为2Cs+2H2O=2Cs++2OH-+H2↑,故答案为:2Cs+2H2O=2Cs++2OH-+H2↑。


科目:高中化学 来源: 题型:
【题目】A、B、D、E、G是原子序数依次增大的五种短周期元素,A与E同主族,A、B和E的原子最外层电子数之和为19,B与G的单质都能与H2反应生成“HX”(X代表B或G)型氢化物,D为同周期主族元素中原子半径最大的元素。
(1)B在元素周期表中的位置是______。
(2)D的两种常见氧化物中均含有____________(填“离子键”或“共价键”)。
(3)E的最高价氧化物对应水化物的浓溶液和木炭共热,反应的化学方程式为____________。
(4)D的最高价氧化物对应水化物的溶液与G的单质反应,反应的离子方程式为___________。
(5)用原子结构解释“B、G单质都能与H2反应生成HX型氢化物”的原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )


A. 图①中ΔH1=ΔH2+ΔH3
B. 图②在催化剂条件下,反应的活化能等于E1+E2
C. 图③表示醋酸溶液滴定 NaOH溶液和氨水混合溶液的电导率变化曲线
D. 图④可表示由CO(g)生成CO2(g)的过程中要放出566 kJ 热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸分别与三种钠盐反应,现象如图。下列分析正确的是( )
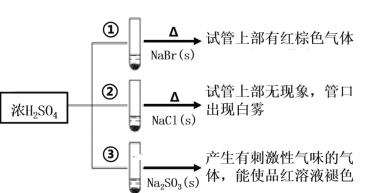
A.②中试管口白雾是HCl遇水蒸气所致,说明酸性:H2SO4>HCl
B.①和③相比可说明氧化性:Br2>SO2
C.对比①和②可以说明还原性:Br->Cl-
D.③中浓H2SO4被还原成SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)图为氢氧燃料电池原理示意图,按照此图的提示,回答以下问题:
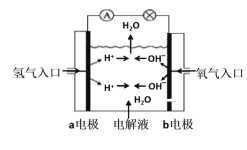
①下列叙述不正确的是___。
A.a电极是负极
B.b电极的电极反应为:4OH--4e-=2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
②若电解质溶液为KOH溶液,则电极反应式为:a极__,b极___。
(2)以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。回答下列问题:
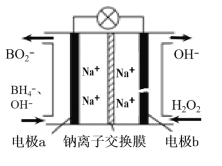
①电池放电时Na+移动方向是:__(填“从左向右”或“从右向左”)。
②电极b采用MnO2,MnO2的作用是__。
③该电池的负极反应为:__。
④每消耗3molH2O2,转移的电子数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图。(X、Y、Z、M、N、P为代号,不为元素符号)则下列说法正确的是( )
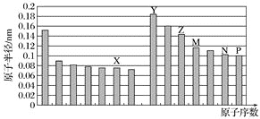
A.Z、N两种元素的离子半径相比,前者较大
B.N、P两种元素的气态氢化物的稳定性相比,前者较稳定
C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z的氧化物能分别溶解于Y的氢氧化物和P的氢化物的水溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铜矿(主要成分为 CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要工艺流程如下:
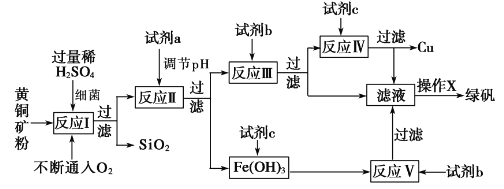
已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表。
沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 4.7 | 2.7 | 7.6 |
完全沉淀pH | 6.7 | 3.7 | 9.6 |
下列说法不正确的是
A. 试剂a可以是CuO或Cu(OH)2,作用是调节pH至3.7~4.7之间
B. 反应I的化学反应方程式为4 CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O,该反应中铁元素被还原
C. 操作X为蒸发浓缩至溶液表面出现晶膜,再冷却结晶
D. 反应Ⅲ的离子方程式为Cu2++Fe==Cu+Fe2+,试剂c参与反应的离子方程式分别为Fe+2H+=Fe2++H2↑,Fe(OH)3+3H+=Fe 3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物G可用于生产全生物降解塑料,在“白色污染”日益严重的今天有着重要的作用。有关转化关系如下:
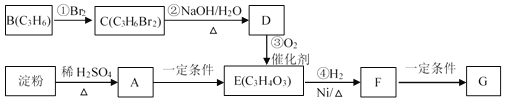
已知:CH3CH2CH2Br + NaOH![]() CH3CH2CH2OH + NaBr
CH3CH2CH2OH + NaBr
请回答下列问题:
(1)物质A的分子式为_______,B的结构简式为_______;
(2)请写出F中含氧官能团的名称_______;
(3)反应①~④中属于加成反应的是_______;
(4)写出由F生成聚合物G的化学方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com