
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 在水中溶解性 |
| 甲苯 | -95 | 110.6 | 0.8669 | 难溶 |
| 苯甲酸钾 | 121.5~123.5 | 易溶 | ||
| 苯甲酸 | 122.4 | 248 | 1.2659 | 微溶 |
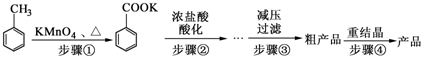
分析 (1)步骤①得到混合物为苯甲酸钾和甲苯,根据题中表中的数据可知,甲苯的密度小于水,分离子两种互不相溶的液体通常用分液的方法;
(2)步骤②用浓盐酸酸化使苯甲酸钾生成苯甲酸,由于苯甲酸微溶于水,所以可以使溶液中苯甲酸析出;
(3)减压过滤装置主要用布氏漏斗和吸滤瓶;
(4)酸化后得到的苯甲酸的混合物中除了苯甲酸外还有其它物质,例如氯化钾等,温度过低这些物质也可以析出;
(5)重结晶时苯甲酸留在热溶液中,过滤后再冷却结晶得苯甲酸,据此答题;
解答 解:(1)步骤①得到混合物为苯甲酸钾和甲苯,根据题中表中的数据可知,甲苯的密度小于水,所以有机相在上层,分离子两种互不相溶的液体通常用分液的方法,
故答案为:上;分液;
(2)步骤②用浓盐酸酸化使苯甲酸钾生成苯甲酸,由于苯甲酸微溶于水,所以可以使溶液中苯甲酸析出,所以用盐酸酸化的目的是,
故答案为:使苯甲酸析出;
(3)减压过滤装置所包含的仪器除减压系统外,主要用布氏漏斗和吸滤瓶,
故答案为:布氏漏斗、吸滤瓶;
(4)酸化后得到的苯甲酸的混合物中除了苯甲酸外还有其它物质,例如氯化钾等,温度过低这些物质也可以析出,
故答案为:其它杂质也有可能析出;
(5)重结晶时苯甲酸留在热溶液中,过滤后再冷却结晶得苯甲酸,所以要趁热过滤,目的是为了减少苯甲酸的损失,
故答案为:为了减少苯甲酸的损失.
点评 本题考查有机物的合成及混合物的分离,明确反应原理、物质的性质、混合物的分离原理是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 3.01×1023个SO2分子的质量为32g | B. | CH4的摩尔质量为16g | ||
| C. | 1molH2O的质量为18g/mol | D. | O的摩尔质量是32g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标况下,22.4L任何物质都含有约6.02×1023个分子 | |
| B. | NO的摩尔质量与6.02×1023个NO分子的质量相等 | |
| C. | 标况下,0.5×6.02×1023个一氧化碳分子所占体积为11.2L | |
| D. | 1molO2所含的分子数与12gC所含的原子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态HBr不导电,因此HBr是非电解质 | |
| B. | 自由移动离子数目多的电解质溶液导电能力不一定强 | |
| C. | CO2的水溶液能导电,因此CO2是电解质 | |
| D. | NaHSO4在水溶液及熔融状态下均可电离成Na+、H+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 | |
| 苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
| 甲醇 | -97 | 64.3 | 0.79 | 互溶 |
| 苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率v(Z)=2.0×10-3 mol/(L•min) | |
| B. | 该温度下此反应的平衡常数K=144 | |
| C. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变 | |
| D. | 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50 mL 1.5 mol•L-1的FeCl2溶液 | B. | 100 mL 3 mol•L-1的NH4Cl溶液 | ||
| C. | 75 mL 3 mol•L-1的KCl溶液 | D. | 50 mL 2 mol•L-1的CaCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com