
| A. | 16O与18O互为同位素;H2${\;}_{\;}^{16}$O、D2${\;}_{\;}^{16}$O、H2${\;}_{\;}^{18}$O、D2${\;}_{\;}^{18}$O互为同素异形体 | |
| B. | SiH4、PH3、HCl的稳定性逐渐增强 | |
| C. | 氧化铁的化学式:FeO | |
| D. | Ca2+的结构示意图为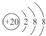 ,NH4Cl的电子式为 ,NH4Cl的电子式为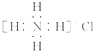 |
分析 A.同种元素的不同单质互为同素异形体,H216O、D216O、H218O、D218O都是化合物,不属于同素异形体;
B.非金属性越强,对应的氢化物的稳定性越强,非金属性大小为:Cl>P>Si;
C.氧化铁为三氧化二铁,FeO为氧化亚铜的化学式;
D.氯化铵的电子式中,氯原子的最外层达到8电子稳定结构,电子式中需要标出氯离子的最外层电子.
解答 解:A.16O与18O为氧元素的不同原子,二者互为同位素,而H216O、D216O、H218O、D218O都是化合物,都是水,为同一种物质,不属于同素异形体,故A错误;
B.非金属性:Cl>P>Si,非金属性越强,其氢化物的稳定性越强,则SiH4、PH3、HCl的稳定性逐渐增强,故B正确;
C.FeO为氧化亚铁的化学式,氧化铁为三氧化二铁,其化学式为:Fe2O3,故C错误;
D.Ca2+的核电荷数为20,最外层为8个电子,其结构示意图为: ,而NH4Cl的电子式中需要标出氯离子的最外层电子,氯化铵正确的电子式为:
,而NH4Cl的电子式中需要标出氯离子的最外层电子,氯化铵正确的电子式为: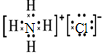 ,故D错误;
,故D错误;
故选B.
点评 本题考查了电子式、化学式、同位素、同素异形体、离子结构示意图的判断及非金属氢化物的稳定性比较,题目难度中等,试题涉及的知识点较多,注意掌握同位素与同素异形体的概念及判断方法,能够正确表示电子式、离子结构示意图、原子结构示意图等.


 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:X>Y>Z | B. | 对应气态氢化物的稳定性:X>Z | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5.+3.-3 | -2 |
| A. | X.Y元素的金属性:X<Y | |
| B. | Z的最高价含氧酸分子式为H3ZO4 | |
| C. | Y的最高价氧化物对应的水化物能溶于氢氧化钠溶液 | |
| D. | Z的氢化物比W的氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
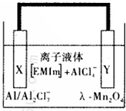 铝是一种高能量载体,是开发电池的理想电极材料.如图所示的室温铝二次电池,采用有机阳离子(EMlm)和 AlCl4-组成的离子液体为电解液,有关反应为Al+Mn2O4$?_{充电}^{放电}$AlMn2O4 下列说法正确的是( )
铝是一种高能量载体,是开发电池的理想电极材料.如图所示的室温铝二次电池,采用有机阳离子(EMlm)和 AlCl4-组成的离子液体为电解液,有关反应为Al+Mn2O4$?_{充电}^{放电}$AlMn2O4 下列说法正确的是( )| A. | 电池放电时,Ac-4-向Y极扩散 | |
| B. | 电池放电时,X是正极 | |
| C. | 电池充电时X极的反应为:4Al2Cl7-+3e-=Al+7AlCl4- | |
| D. | 铝作为负极材料的比能量高于锂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
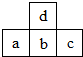 图为周期表中短周期的一部分.若a原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )
图为周期表中短周期的一部分.若a原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是c>b>a>d | |
| B. | c的氢化物比a的氢化物稳定 | |
| C. | b和d可结合成bd32-和bd42-阴离子 | |
| D. | a、b、c的最高价氧化物对应水化物的酸性强弱关系是c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与K+距离相等且最近的O2-共有8个 | |
| B. | 与K+距离相等且最近的O2-构成的多面体是正八面体 | |
| C. | 与K+距离相等且最近的K+有8个 | |
| D. | 一个KO2晶胞中的K+和O2-粒子数均为8个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
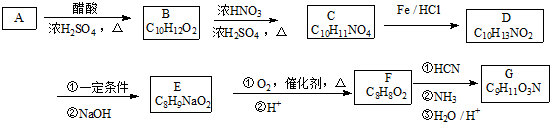
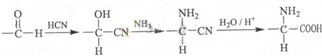
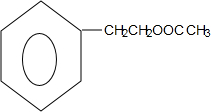 +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$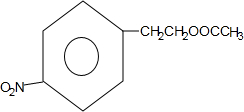 +H2O.
+H2O.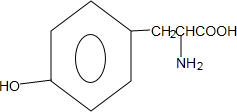 .
.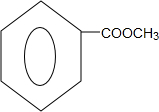 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com