
【题目】(1)t1 ℃时,密闭容器中,通入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位: mol·L-1)变化如下表所示:
CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位: mol·L-1)变化如下表所示:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①一定处于平衡状态的时间段为____________。
②5~6 min时间段内,平衡移动方向为_______________ (填“向左移动”或“向右移动”),根据表中数据判断,平衡移动的原因是________(填字母编号)。
a.增加了H2O(g)的量 b.增加氢气浓度 c.使用催化剂 d.降低温度
③t2 ℃时(t2>t1),在相同条件下发生上述反应,达平衡时,CO浓度________c1(填“>”“<”或“=”)。
(2)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数随温度变化情况如图所示:
FeO(s)+CO(g)的平衡常数随温度变化情况如图所示:
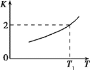
①用CO还原FeO制备Fe的反应是___________ (填“吸热”或“放热”)反应。
②温度为T2时,实验测得该反应体系中CO浓度为CO2的2.5倍,则T2______T1(填“>”“<”或“=”)。
(3)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH<0;②CO2(g)+H2(g)
CH3OH(g) ΔH<0;②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图所示。
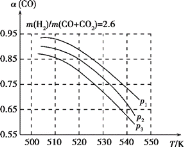
图中的压强由大到小的顺序为____________,判断理由是_________________________;
试解释CO平衡转化率随温度升高而减小的原因是_______________________。
【答案】3min~4min 向右移动 a > 放热 > p1>p2>p3 相同温度下,由于反应①为气体分子数减小的反应,增大压强,平衡正向移动,CO转化率增大;而反应②为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高 升高温度时,反应①为放热反应,平衡向向左移动,使得体系中CO的量增大;反应②为吸热反应,平衡向右移动,产生CO的量增大;总结果,随温度升高,使CO的转化率降低
【解析】
(1)①反应达到平衡状态时,各物质的浓度不变;②5min-6min时间段内CO浓度减小、H2O浓度不变、CO2浓度增大,平衡向浓度增大的方向移动;③该反应的正反应为放热反应,根据温度对平衡移动的影响分析;
(2)①升高温度,化学平衡常数增大,根据温度对平衡移动的影响分析;②K(T2)与K(T1)的相等大小判断;
(3)相同温度下,由于反应①为气体分子数减小的反应,增大压强平衡正向移动;而反应②为气体分子数不变的反应,增大压强时平衡不移动;升高温度时,反应①为放热反应,平衡向左移动;反应②为吸热反应,升高温度平衡向右移动,据此分析解答。
(1)①从表格中数据分析,第3-4min时,体系中各物质的浓度不再变化,说明已经达到平衡状态,故答案为:3min~4min;
②5min~6min时间段内,H2O的浓度增大,CO浓度减小,说明是增加了H2O的量,平衡正移,故答案为:向右移动;a;
③该反应的正反应为放热反应,升高温度,平衡逆向移动,CO转化率减小,则CO浓度>c1,故答案为:>;
(2)①升高温度,化学平衡常数增大,说明Fe(s)+CO2(g)FeO(s)+CO(g)为吸热反应,则其逆反应为放热反应,故答案为:放热;
②K(T2)=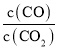 =2.5>K(T1),根据图象信息,K越大,对应的温度越高,所以T2>T1,故答案为:>;
=2.5>K(T1),根据图象信息,K越大,对应的温度越高,所以T2>T1,故答案为:>;
(3)相同温度下,由于反应①为气体分子数减小的反应,增大压强,平衡正向移动,CO转化率增大;而反应②为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高,所以压强p1>p2>p3;
升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO的量增大;反应②为吸热反应,平衡向右移动,产生CO的量增大;总结果,随温度升高,使CO的转化率降低,故答案为:p1>p2>p3;相同温度下,由于反应①为气体分子数减小的反应,增大压强,平衡正向移动,CO转化率增大;而反应②为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高;升高温度时,反应①为放热反应,平衡向向左移动,使得体系中CO的量增大;反应②为吸热反应,平衡向右移动,产生CO的量增大;总结果,随温度升高,使CO的转化率降低。


科目:高中化学 来源: 题型:
【题目】对如图所示的两种化合物的结构或性质描述正确的是( )
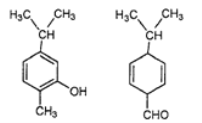
A.均能与溴水发生加成反应
B.分子中肯定共平面的碳原子数相同
C.二者互为同分异构体
D.可以用红外光谱区分,但不能用核磁共振氢谱区分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应热的叙述中正确的是 ( )
①已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ· mol-1,则氢气的燃烧热ΔH=-241.8 kJ· mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:下表数据可以计算出![]() (g)+3H2(g)
(g)+3H2(g)![]()
![]() (g)的焓变
(g)的焓变
共价键 | C—C | C=C | C—H | H—H |
键能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
⑤根据盖斯定律可推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2(g)时,放出的热量相等
⑥25 ℃、101 kPa时,1 mol碳完全燃烧生成CO2(g)所放出的热量为碳的燃烧热
A.①②③④B.③④⑤C.④⑤D.⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述及解释正确的是
A. 2NO2(g)(红棕色)![]() N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B. H2(g)+I2(g)![]() 2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
C. FeCl3+3KSCN![]() Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
D. 对于N2+3H2![]() 2NH3,平衡后,压强不变,充入O2,平衡左移
2NH3,平衡后,压强不变,充入O2,平衡左移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.向1 L 1 mol·L-1 NaClO溶液中通入足量CO2,溶液中HClO的分子数为NA
B.标准状况下,体积均为2.24 L的CH4与H2O含有的电子总数均为NA
C.2 mol NO与1 mol O2在密闭容器中充分反应,产物的分子数为2NA
D.由13 g乙酸与2 g CO(NH2)2(尿素)形成的混合物中含有的氢原子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O | K1=1.75×10-5mol·L-1 |
CH3COO-+H2O | K2=5.71×10-10mol·L-1 |
现将 50 mL 0.2 mol·L-1醋酸与 50 mL 0.2 mol·L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是
A.溶液甲的pH>7
B.对溶液甲进行微热,K1、K2同时增大
C.若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大
D.若在溶液甲中加入 5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的 K1 会变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向盛50mL0.100mol·L-1盐酸的两个烧杯中各自匀速滴加50mL的蒸馏水、0.100mol·L-1醋酸铵溶液,测得溶液pH随时间变化如图所示。已知Ka(CH3COOH)=1.8×10-5,Kb(NH3·H2O)=1.8×10-5。下列说法正确的是( )

A.曲线X是盐酸滴加蒸馏水的pH变化图,滴加过程中溶液各种离子浓度逐渐减小
B.曲线Y上的任意一点溶液中均存在c(CH3COO-)<c(NH4+)
C.a点溶液中n(Cl-)+n(CH3COO-)+n(OH)-n(NH4+)=0.01mol
D.b点溶液中水电离的c(H+)是c点的102.37倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A. c(OH-)/c(NH3·H2O) B. n(OH-)
C. c(NH3·H2O)/c(OH-) D. c(H﹢)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com