
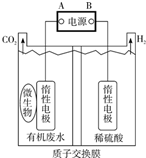
 在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2,其原理如图所示,下列有关说法不正确的是( )
在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2,其原理如图所示,下列有关说法不正确的是( )| A. | 电极B极为负极 | |
| B. | 与电源A极相连的惰性电极上发生的反应为:CH3COOH-8e-+H2O=2CO2↑+8H+ | |
| C. | 通电后,H+通过质子交换膜向右移动,最终右侧溶液pH减小 | |
| D. | 通电后,若有0.1molH2生成,则转移0.2mol电子 |
分析 A.连接B电极的电极上生成氢气,说明该电极上氢离子得电子,则为电解池阴极,电解池阴极连接原电池负极;
B.与电源A极相连的惰性电极为阳极,阳极上乙酸失电子生成二氧化碳和氢离子;
C.通电后,左侧生成H+右侧H+放电生成氢气,所以H+通过质子交换膜向右移动,相当于稀硫酸中H+不参加反应;
D.右侧电极反应式为2H++2e-=H2↑,根据氢气和转移电子之间的关系式计算.
解答 解:A.连接B电极的电极上生成氢气,说明该电极上氢离子得电子,则为电解池阴极,电解池阴极连接原电池负极,所以电极B极为负极,故A正确;
B.与电源A极相连的惰性电极为阳极,阳极上乙酸失电子生成二氧化碳和氢离子,电极反应式为CH3COOH-8e-+H2O=2CO2↑+8H+,故B正确;
C.通电后,左侧生成H+右侧H+放电生成氢气,所以H+通过质子交换膜向右移动,相当于稀硫酸中H+不参加反应,所以氢离子浓度不变,溶液的pH不变,故C错误;
D.右侧电极反应式为2H++2e-=H2↑,根据氢气和转移电子之间的关系式知,若有0.1molH2生成,则转移0.2mol电子,故D正确;
故选C.
点评 本题考查电解原理,为高频考点,明确原电池和电解池原理及离子放电顺序是解本题关键,难点是电极反应式的书写,注意:C中通过交换膜过来的氢离子物质的量等于电极上放电的氢离子物质的量,题目难度不大.


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:选择题
| A. |  1,4-二甲基丁烷 1,4-二甲基丁烷 | B. | 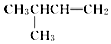 2-甲基-1-丁烯 2-甲基-1-丁烯 | ||
| C. | 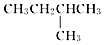 2-甲基丁烷 2-甲基丁烷 | D. | CH2Cl-CH2Cl 二氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铝片和硫酸反应制氢气,硫酸浓度越高,反应速率越快 | |
| B. | 锌和稀硫酸反应制氢气时,加入少量CuSO4溶液,可加快反应速率 | |
| C. | 增大压强、升高温度和使用催化剂均一定使反应速率加快 | |
| D. | 在碳酸钙和盐酸反应中,加多些碳酸钙可使反应速率明显如快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4•5H2O | B. | FeSO4•7H2O | C. | KAl(SO4)2•12H2O | D. | MgSO4•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L水含有的分子数为0.1NA | |
| B. | 12g14C含有的中子数为8NA | |
| C. | 1 L0.1 mol•L-1 FeCl3溶液含阳离子数大于0.1NA | |
| D. | 1molN2和3 mol H2充分反应后,生成气体的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 催化剂可以改变该反应的热效应 | B. | 该反应是个放热反应 | ||
| C. | 反应物总能量低于生成物 | D. | 化学反应遵循质量守恒定律 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应过程中,旧键断裂放出能量,新键生成吸收能量 | |
| B. | 常温下,任何酸、碱间反应,每生成1mol水时的中和热都相同 | |
| C. | 放热反应在常温下都能自发进行 | |
| D. | 升高温度使活化分子百分数增大,反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 2:3 | C. | 3:5 | D. | 3:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com