(2012?天津模拟)为改善大气质量,国家拟于“十二五”期间,力争将CO
2变为燃料或有机化学产品的构想变为现实,将二氧化硫(SO
2)排放量减少8%,氮氧化物(NO
x)排放量减少10%.
I.一种将CO
2变为燃料或有机化学产品的构想分成3个步骤:
①利用浓碳酸钾溶液吸收空气中的CO
2;
②将第①步吸收液电解产生H
2和O
2,同时分离出CO
2;
③将第②步产生的H
2(g)和CO
2(g)在一定条件下转化成CH
4(g)和H
2O(l).
已知:H
2(g)+
O
2(g)=H
2O(l)△H
1=-285.8kJ/mol
CH
4(g)+2O
2(g)=CO
2(g)+2H
2O(l)△H
2=-889.6kJ/mol
写出第③步反应的热化学方程式为
CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-253.6kJ/mol
CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-253.6kJ/mol
.
II.目前,消除大气污染有多种方法.
(1)处理NO
x的一种方法是利用甲烷催化还原NO
x.写出甲烷直接将NO
2还原得到无污染的产物的化学方程式
CH4+2NO2═N2+CO2+2H2O
CH4+2NO2═N2+CO2+2H2O
.
(2)降低汽车尾气的方法之一是在排气管上安装催化 转化器,发生如下反应:
2NO(g)+2CO(g)?N
2(g)+2CO
2(g);△H<0.
该反应的化学平衡常数表达式为K=
.
在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图1所示.
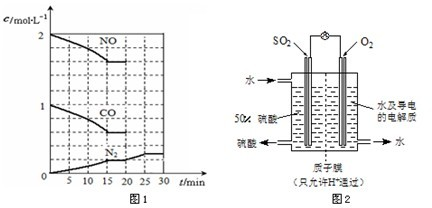
若保持温度不变,20min时再向容器中充入CO、N
2各0.6mol,平衡将
不
不
移动(填“向左”、“向右”或“不”).
若20min时改变反应条件,导致N
2浓度发生如图1所示的变化,则改变的条件可能是
②
②
(填序号).
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO
2的量
(3)最近,某科研单位研制成功一种处理SO
2的方法:利用电化学原理将发电厂产生的大量SO
2制成硫酸,装置如图2,其电池反应方程式为:2SO
2+O
2+2H
2O=2H
2SO
4,该电池电动势为1.06V.实际过程中,将SO
2通入电池的
负
负
极(填“正”或“负”),负极反应式为
SO2-2e-+2H2O=4H++SO42-
SO2-2e-+2H2O=4H++SO42-
.用这种方法处理SO
2废气的优点是可回收大量有效能,副产品为H
2SO
4,减少环境污染.



