
下列有关化学用语正确的是
A.中子数为18的硫原子:3416S
B.氨分子的电子式: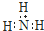
C.苯乙酸钠的结构简式: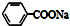
D.H2SO3的电离方程式:H2SO3?2H++SO32
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届天津市和平区高三第二次模拟考试化学试卷(解析版) 题型:填空题
A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
A | ||||||
B | C[ | D | ||||
E | F | G | H | |||
请回答下列问题:
(1)写出E元素在周期表中的位置 。
(2)B与D可形成三原子分子X,X的电子式为 。
(3)E、F、H所形成的简单离子的半径由大到小的顺序为 (用离子符号表示)。
(4)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(5)由A、C、D三种元素组成的强电解质Z溶于水时能促进水的电离,测得Z的水溶液pH<7,其原因是 (用离子方程式来表示)。
(6)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如图所示。
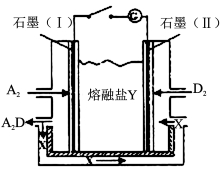
写出石墨(I)电极上发生的电极反应式 。
(7)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO 4 溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南嘉积中学高二下期中理科化学试卷(解析版) 题型:选择题
在卤代烃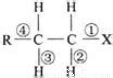 中,有关化学键的叙述,下列说法不正确的是
中,有关化学键的叙述,下列说法不正确的是
A.当该卤代烃发生取代反应时,被破坏的键一定是①
B.当该卤代烃发生消去反应时,被破坏的键一定是①和③
C.当该卤代烃在碱性条件下发生水解反应时,被破坏的键一定是①
D.当该卤代烃发生消去反应时,被破坏的键一定是①和④
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三下学期考前练习化学试卷(解析版) 题型:选择题
常温下,下列溶液中微粒的物质的量浓度关系一定正确的是
A.NaHCO3溶液中:c(H+) +c(H2CO3)=2c(CO32-) +c(OH-)
B.向0.1mol·L-1的NH4Cl溶液中通入一定量的NH3后:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.向CH3COOH溶液中滴加NaOH使pH>7溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.0.3mol·L-1的HY溶液与0.3mol·L-1的NaOH溶液等体积混合后所得pH=9的溶液中:c(OH-)-c(HY)=c(H+)=1×10-9mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三下学期考前练习化学试卷(解析版) 题型:选择题
下列实验操作不正确的是

A.焰色反应实验时,在蘸取待测溶液,先用稀盐酸洗净铂丝并灼烧至无色
B.将2.5gCuSO4•5H2O溶于水配成100.0mL溶液,得到0.1mol•L-1硫酸铜溶液
C.用装置甲吸收SO2
D.用装置乙制取无水MgCl2
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川二中高三三模理综化学试卷(解析版) 题型:填空题
氮化铝(AlN)是一种新型无机非金属材料。某A1N样品仅含有A12O3杂质,为测定AlN的含量,设计如下三种实验方案。
已知:A1N+NaOH+H2O===NaA1O2+NH3↑
[方案Ⅰ]取一定最的样品,用以下装置测定样品中AlN的纯度(夹持仪器已略去)。
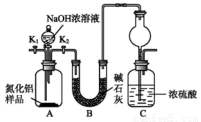
(1)上图C装置中球形干燥管的作用是________________________;
(2)完成以下实验步骤:组装好实验装置,首先________________再加入实验药品,接下来的实验操作是______________,打开分液漏斗活塞,加入 浓溶液,至不再产生气体.打开 K1,通入氨气一段时间,测定C装置反应前后的质量变化•通入氮气的目的是________________________;
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见________________________;
【方案二】
用下图装置测定mg样品中A1N的纯度(部分夹持装置已略去);
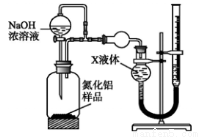
(4)为测定生成气体的体积,量气装置中的X液体可以是_________;
a.CCl4 b.H2O c.NH4Cl溶液 d.
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则A1N的质量分数____________________;
【方案三】
按下图步骤测定样品中A1N的纯度:
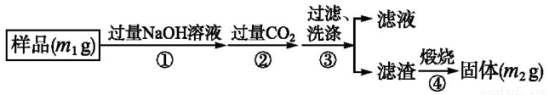
(6)步骤②生成沉淀的离子方程式为________________________;
(7)若在步骤③中未洗涤,测定结果将___________(填“偏高”“偏低’或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川二中高三三模理综化学试卷(解析版) 题型:选择题
下列实验装置或操作正确的是

A.图①向Ⅰ中通入过量CO2,出现白色沉淀,则溶液中一定含有AlO2-
B.图②两支试管中的蛋白质济液均会变性
C.图③装置用来除去C2H4中的杂质SO2
D.图④装置用来灼烧海带成灰
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都石室中学高二4月月考化学试卷(解析版) 题型:选择题
已知C-C单键可以绕键轴旋转,结构简式为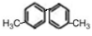 的烃,下列说法中正确的是
的烃,下列说法中正确的是
A.在 FeBr3的催化作用下可与溴水发生取代反应
B.该烃与足量 H2的加成产物一氯代物最多有四种
C.分子中至少有10个碳原子处于同一平面上
D.该烃是苯的同系物
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三第七次模拟理综化学试卷(解析版) 题型:填空题
由碳的氧化物直接合成乙醇燃料已进入大规模生产。
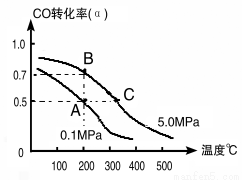
(1)如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g) △H;若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇,CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g) △H;若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇,CO的转化率(α)与温度、压强的关系如下图所示。
已知:2CO(g)+O2(g)===2CO2(g) △H1=-566kJ·mol-1
2H2(g)+O2(g)===2H2O(l) △H2=-572kJ·mol-1
CH3CH2OH(g)+3O2(g)===2CO2(g)+ 3H2O(g) △H3=-1366kJ·mol-1
H2O(g)===H2O(l) △H4=-44kJ·mol-1
①△H= kJ·mol-1
②若A、C两点都表示达到的平衡状态,则从反应开始到达平衡状态所需的时间tA tC(填“﹥”、“﹤”或“﹦”)。
③若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K= ;
④熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极上CO反应的电极反应式为 。
(2)工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH 的平衡常数。请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是: 。
(3)目前工业上也可以用CO2来生产甲醇。一定条件下发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
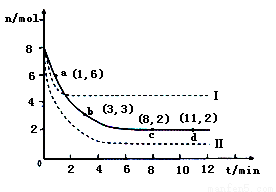
①请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 。
(4)将标准状况下4.48L CO2通入1L 0.3mol·L-1 NaOH溶液中完全反应,所得溶液中微粒浓度关系正确的是
A.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.c(OH-)+c(CO32-)=c(H2CO3)+c(H+)
C.c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com