
【题目】实验室用2.0 mol/L NaCl溶液配制100mL 0.10 mol/L NaCl溶液。
(1)计算:配制上述溶液,需要2.0 mol/L NaCl溶液_____________mL;
(2)称量:用量筒正确量取所需溶液;
(3)溶解:所需仪器是_____________、_____________;
(4)转移:将烧杯中的溶液沿着玻璃棒小心引流到___________________中;
(5)洗涤:将烧杯和玻璃棒洗涤2~3次并将洗涤液也都注入容量瓶中;
(6)定容:往容量瓶中加蒸馏水至距刻度线_________cm处,改用__________________加蒸馏水至液面与刻度线相切。盖好瓶塞摇匀;
(7)配制过程中出现以下情况,对所配溶液浓度有何影响(填偏高、偏低、不变):
①没有洗涤烧杯和玻璃棒_____________;
②量取2.0 mol/L NaCl溶液时俯视量筒的刻度线_____________。
【答案】5.0 烧杯 玻璃棒 100mL容量瓶 1~2 胶头滴管 偏低 偏低
【解析】
(1)根据稀释前后氯化钠物质的量不变计算;
(3)在烧杯中稀释浓盐酸,并用玻璃棒搅拌;
(4)用100mL容量瓶定容;
(6)根据定容操作的规范操作回答;
(7)根据cB=![]() 分析误差。
分析误差。
(1)设需要2.0 mol/L NaCl溶液VmL,2.0 mol/L×V mL =100mL ×0.10 mol/L;V=5.0;
(3)在烧杯中稀释浓盐酸,并用玻璃棒搅拌,所需仪器是烧杯、玻璃棒;
(4)转移:将烧杯中的溶液沿着玻璃棒小心引流到100mL容量瓶中;
(6)定容:往容量瓶中加蒸馏水至距刻度线1~2cm处,改用胶头滴管加蒸馏水至液面与刻度线相切。
(7)①没有洗涤烧杯和玻璃棒,溶质物质的量偏少,所配溶液浓度偏低;
②量取2.0 mol/L NaCl溶液时俯视量筒的刻度线,2.0 mol/L NaCl溶液体积偏小,溶质偏少,所配溶液浓度偏低。


科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL 0.200 0 mol/LNH4Cl溶液中逐滴加入0.2000 mol/LNaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是
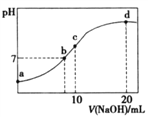
A. a点溶液中:c(H+)+c(NH3·H2O)=c(OH-)+c(NH4+)
B. b点溶液中:c(Cl-)=c(Na+)>c(H+)=c(OH-)
C. c点溶液中:c(NH3·H2O)+ c(NH4+)= c(Cl-)+ c(OH-)
D. d点溶液中:c(Cl-)> c(NH3·H2O)> c(OH-)> c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】指出下列分子中带*号的原子采用的杂化方式:
(1)HO2________
(2)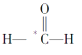 _________
_________
(3)*CO2________
(4)CHCH2OH_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )
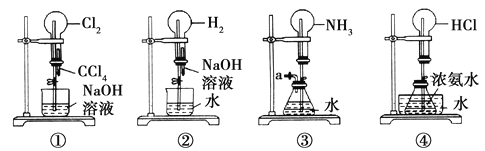
A. 挤压装置①的胶头滴管使CCl4全部进入烧瓶,并打开止水夹
B. 挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,并打开止水夹
C. 用鼓气装置从装置③的a处不断鼓入空气,并打开止水夹
D. 向装置④的水槽中慢慢加入足量浓硫酸,并打开止水夹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,有关说法不正确的是( )
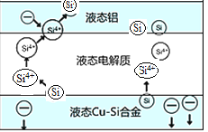
A.电子由液态Cu-Si合金流出,从液态铝电极流入
B.液态铝电极与负极相连,作为电解池的阴极
C.在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原
D.三层液熔盐的作用是增大电解反应的面积,提高沉硅效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分。
(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8 kJmol-1、-283.0 kJmol-1和-726.5 kJmol-1。请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:________。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(K)
CH3OH(g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(K)
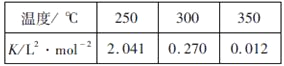
①由表中数据判断△H_______0(填“>”、“=”或“<”)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为________,则反应速率v(H2)=__________。
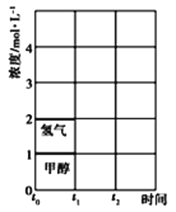
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的一半,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图_______(其他条件不变,曲线上必须标明氢气、甲醇)。
CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的一半,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图_______(其他条件不变,曲线上必须标明氢气、甲醇)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质相互混合反应后,最终有白色沉淀生成的是( )
①金属钠投入CuCl2溶液中
②向饱和Na2CO3溶液中通入足量CO2
③少量Ca(OH)2投入过量NaHCO3溶液中
④向NaAlO2溶液中滴入少量盐酸
⑤过量NaOH溶液和明矾溶液混合
A.只有①③④⑤B.只有①④C.只有②③D.只有②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:
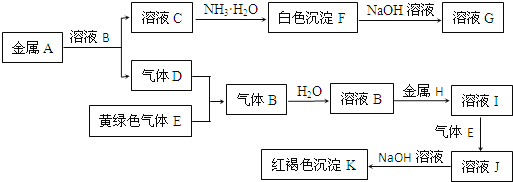
(1)写出下列物质的化学式:
A是_______________,D是___________,K是_______________。
(2)写出反应“C→F”的离子方程式:_______________________。
(3)写出反应“F→G”的化学方程式:_______________。
(4)在溶液I中滴入NaOH溶液,可观察到的现象是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com