
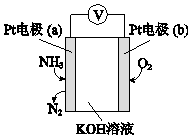
| A. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| B. | 电极a的反应式为2NH3-6e-+6OH-═N2+6H2O | |
| C. | O2在电极b上发生还原反应 | |
| D. | 溶液中OH-向电极a移动 |
分析 Pt电极a通入氨气生成氮气,说明氨气被氧化,为原电池负极,则Pt电极b为正极,氧气得电子被还原,结合电极方程式解答该题.
解答 解:A.反应中N元素化合价升高3价,O元素化合价降低4价,根据得失电子守恒,消耗NH3与O2的物质的量之比为4:3,故A错误;
B.负极是氨气发生氧化反应变成氮气,且OH-向a极移动参与反应,故电极反应式为2NH3-6e-+6OH-=N2+6H2O,故B正确;
C.Pt电极b为正极,氧气得电子被还原发生还原反应,故C正确;
D.因为a极为负极,则溶液中的OH-向负极a移动,故D正确.
故选A.
点评 本题考查了原电池原理,根据O、N元素化合价变化判断正负极,再结合反应物、生成物及得失电子书写电极反应式,注意书写电极反应式时要结合电解质特点,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
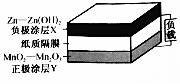 未来5-10年,可穿戴电池--纸质电池将用干诸多可穿戴设备上.某二次纸质电池的基本构造如图所示.下列有关该电池说法正确的是( )
未来5-10年,可穿戴电池--纸质电池将用干诸多可穿戴设备上.某二次纸质电池的基本构造如图所示.下列有关该电池说法正确的是( )| A. | 放电电流由负极涂层经外电路流向正极涂层 | |
| B. | 充电时正极涂层与外接电源正极相连,发生还原反应 | |
| C. | 放电时每消耗65 g Zn通过纸质隔膜的电子为2 mol | |
| D. | 充电时阳极反应式为Mn2O3+2OH--2e-═2MnO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 在AlCl3溶液中滴加过量氨水 | 有白色沉淀生成 | 实验室常用此法制备Al(OH)3 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 取少量Fe(NO3)2试样加水溶解,加稀H2SO4酸化 | 滴加KSCN溶液,溶液变为红色 | 该Fe(NO3)2试样已经变质 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在无色溶液中:NH4+、Fe2+、SO42-、CO32- | |
| B. | 在含大量Fe3+溶液中:NH4+、Na+、Cl-、SCN- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、SO32- | |
| D. | 使石蕊变红色的溶液中:K+、Fe2+、Cl-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
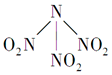 科学家最近研制出有望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
科学家最近研制出有望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )| A. | 分子中N、O间形成的共价键是非极性键 | |
| B. | 分子中4个氮原子共平面 | |
| C. | 该分子中的中心氮原子还有一对孤电子对 | |
| D. | 15.2 g该物质含有6.02×1022个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在其他条件不变时,增加压强,N2的体积分数不变 | |
| B. | 前5 s内,用CO表示的反应速率等于0.1 mol•L-1•s-1 | |
| C. | 10 s时密闭容器中压强维持不变 | |
| D. | 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业制硅:用焦炭在高温下还原二氧化硅可制得高纯硅 | |
| B. | 工业冶炼铁:需要用到的原料有铁矿石、焦炭、空气和石灰石 | |
| C. | 工业冶炼镁:电解熔融的无水氯化镁,可以得到金属镁 | |
| D. | 工业制玻璃:将石灰石、纯碱、石英在玻璃熔炉中高温熔融制得 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com