
科目:高中化学 来源: 题型:阅读理解
| 元素 | 性质或结构信息 |
| X | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼. |
| Y | 二价阳离子的外围电子层排布为3d9 |
| T | 原子核外s轨道电子总数等于p轨道电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 |
| Q | 第三周期主族元素中原子半径最小 |


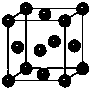
查看答案和解析>>
科目:高中化学 来源: 题型:
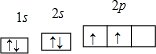


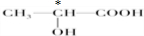
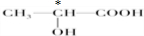
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 氟化物 | X | Y | Z |
| 熔点/K | 1266 | 1534 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:
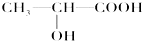
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com