
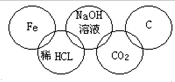
 某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )
某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )| A. | 1个、复分解反应 | B. | 2个、分解反应 | C. | 3个、化合反应 | D. | 2个、置换反应 |
分析 相连环物质间能发生反应,发生的反应有:Fe+2HCl═FeCl2+H2↑、HCl+NaOH═NaCl+H2O、CO2+2NaOH═Na2CO3+H2O、
CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO,以此来解答.
解答 解:由信息可知,相连环物质间能发生反应,不相连环物质间不能发生反应,
Fe+2HCl═FeCl2+H2↑为置换反应,HCl+NaOH═NaCl+H2O为复分解反应,
CO2+2NaOH═Na2CO3+H2O为复分解反应,CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO为化合反应,
显然没有没有涉及的基本反应类型为分解反应,置换反应和有单质参加的化合反应都属于氧化还原反应,氧化还原反应为2个,
故选B.
点评 本题考查氧化还原反应和四种基本反应类型,明确发生的化学反应是解答本题的关键,并利用氧化还原反应和四种基本反应类型的关系来解答.


科目:高中化学 来源: 题型:选择题
| A. | HCl→H2SO4→H2S→NaOH→CO2 | B. | NaCl→Na2SO4→NaOH→H2S→CO2 | ||
| C. | Na2S→Na2SO4→NaCl→NaOH→CO2 | D. | Na2SO4→HCl→H2S→NaOH→CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
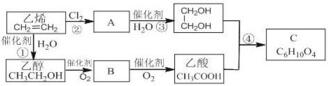
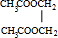 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在如图所示的物质转化关系中,A是一种活泼金属,B是常见的无色液体,在常温下C、E都是气体.请回答下列问题:
在如图所示的物质转化关系中,A是一种活泼金属,B是常见的无色液体,在常温下C、E都是气体.请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗净的滴定管和容量瓶可以放进烘箱中烘干 | |
| B. | 用10mL量筒量取10.00mLNaCl溶液 | |
| C. | 酸式滴定管装标准溶液前,必须先用该溶液润洗2~3次 | |
| D. | 用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com