
【题目】X、Y、Z、W 为短周期主族元素,其常见化合价与原子半径的关系如图所示。已知四种元素中只有 Y 与 Z 同周期,下列说法正确的是( )
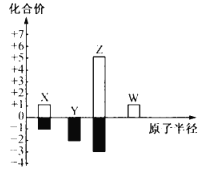
A.简单氢化物的稳定性:Y<Z
B.X、Y、Z 可组成盐类化合物
C.X 的氧化物中不可能含非极性键
D.W 的最高价氧化物对应水化物为弱碱
【答案】B
【解析】
X、Y、Z、W 为短周期主族元素,原子半径依次增大,且只有Y 与 Z 同周期,X的常见化合价为+1和-1价,则X为H元素,Y的常见化合价为-2价,则Y为O元素,Z的常见化合价为+5价和-3价,则Z为N元素,W的常见化合价为+1价,则W为Na元素,据此分析解答。
A.Y为O元素,Z为N元素,非金属性越强,其简单氢化物的稳定性越强,非金属性:O>N,则简单氢化物的稳定性:Y>Z,故A错误;
B.X为H元素,Y为O元素,Z为N元素,X、Y、Z 可组成NH4NO3,为铵盐,故B正确;
C.X为H元素,X的氧化物有H2O和H2O2, H2O2中含极性键和非极性键,故C错误;
D.W为Na元素,其最高价氧化物对应水化物为氢氧化钠,属于强碱,故D错误;
答案选B。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】(1)为了检验和除去下表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内。
物质 | 检验试剂 | 除杂试剂 |
(Ⅰ)甲烷(乙烯) | ________。 | ________。 |
(Ⅱ)酒精(水) | ________。 | ________。 |
①检验试剂:
A.无水硫酸铜 B.酸性高锰酸钾溶液
C.水 D.氢氧化钠溶液
②除杂试剂:
a.无水硫酸铜 b.乙酸
c.新制的生石灰 d.溴水
除杂时,乙烯发生反应的化学方程式为____________________。
(2)如图,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
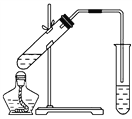
试回答:
在右试管中通常加入________溶液,实验生成的乙酸乙酯,其密度比水________,是有特殊香味的液体。分离右试管中所得乙酸乙酯的操作为(只填名称)________。反应中加入浓硫酸的作用是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工原料。
Ⅰ、某学习小组同学设计了下图所示的实验装置(部分夹持仪器未画出),进行氨气实验室制备且探究氨气的还原性及产物的检验。
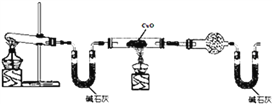
实验现象为:黑色CuO变为红色;干燥管中无水CuSO4粉末变为蓝色;同时生成一种无色无味无污染的气体。
(1)请写出大试管中反应的化学方程式_______________________________________。
(2)请写出氨气与CuO反应的化学方程式_________________________________________。
(3)该装置存在明显缺陷,请指出存在的问题______________________。
Ⅱ、哈伯因为将氮气和氢气在一定条件下合成氨气的成果面获得1918年诺贝尔化学奖。现将1molN2和3molH2充入一恒容的密闭容器中,使其在一定条件下达到平衡N2+3H2![]() 2NH3,下列哪些状态一定是达到平衡的状态?(_____)
2NH3,下列哪些状态一定是达到平衡的状态?(_____)
A.混合气体的平均相对分子质量不随时间改变而改变的状态
B.N2、H2、NH3的总物质的量不随时间改变而改变的状态
C.混合气体的密度不随时间改变而改变的状态
D.单位时间内0.1molNH3分解的同时,有0.05molN2生成的状态
Ⅲ、下图是一种电化学制备NH3的装置,图中陶瓷在高温时可以传输H+。
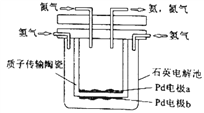
(1)H+经质子传输陶瓷由_____________流向_______________。(选填“a”或“b”)
(2)阴极发生的电极反应为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义。回答下列问题:
(1)CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) △ H2= b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H=________kJ/mol
(2)某温度下,在容积为2 L的密闭容器甲中投入8molCO2(g)、16molH2(g)发生反应:
CO2 (g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
甲容器15 min后达到平衡,此时CO2的转化率为75%。则015 min内用二氧化碳表示平均反应速率v(CO2)=_______,计算此条件下该反应的平衡常数K= __________。
(3)捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
①下列物质中不可能作为CO2捕获剂的是___________。
A.Na2CO3 B.NaOH C.CH3CH2OH D.NH4Cl
②用(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
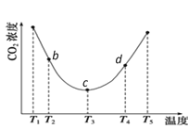
I. c点的逆反应速率和d点的正反应速率的大小关系为
V逆c _____V正d (填“>”、“=”或“<”)
II. b、c、d三点的平衡常数K b 、K c、 Kd 从大到小的顺序为_______。(填“>”、“=”或“<”)
III.T3~T4温度区间,容器内CO2气体浓度呈现增大的变化趋势,其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019 年诺贝尔化学奖授予英国科学家古德纳夫及另外两位科学家,以表彰他们在锂离子电池研究中的杰出贡献。 LiFePO4是用于制备大功率锂离子电池的正极材料 ,且一种制备流程如下:
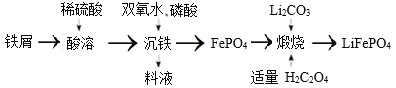
下列有关说法不正确的是
A.LiFePO4中Fe的化合价为+2
B.“沉铁”过程中双氧水作氧化剂
C.料液可循环利用
D.“煅烧”中有大量的CO2 、CO生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是空气污染物 ,含有SO2 的尾气需处理后才能排放,有多种方法可除 去尾气中SO2。回答下列问题:
(1)氨水吸收法。利用氨水吸收烟气中的SO2, 其相关反应的主要热化学方程式如下:
SO2(g)+NH 3 H2O(aq)=NH4HSO3(aq) △H1=akJmol-1;
NH 3 H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(1)△H2= b kJ mol-1;
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4 (aq)△H3 =ckJ mol-1;
则反应 2SO2(g)+4 NH 3 H2O(aq)+ O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=___________kJ mol-1(用含a、b、c的代数式表示)。
(2)热解气还原法。已知CO与SO2 在加热和催化剂作用 下生成生成S(g)和CO2。
①该反应的化学方程式为__________。
②在T °C时,向lL恒容的密闭容器中入充1 mol CO、0.5molSO2发生上述反应(S为气态).5min时达到化学平衡,平衡时测得SO2的转化率为90 %,则 0 ~ 5 mi n 内 反应的平均速率v(SO2)=__________。此温度下该反应的平衡常数 K1=_______。下列选项中能够说明该反应已经达到平衡状态的是_____(填字母)。
a.体系的压强保持不变
b.混合气体的密度保持不变
c.混合气体的平均摩尔质量保持不变
d.单位时间内CO消耗的物质的量与 SO2 生成的物质的量之比为2:1
(3)氧化锌吸收法。配制ZnO悬浊液(含少量 MgO、CaO)在吸收塔中封闭循环脱硫。发生的主要反应为ZnO十SO2 = ZnSO3(s).吸收过程中,测得pH、吸收效率η随 时间t的变化如图a所示。溶液中含硫元素微粒各组分浓度之比如图b所示。
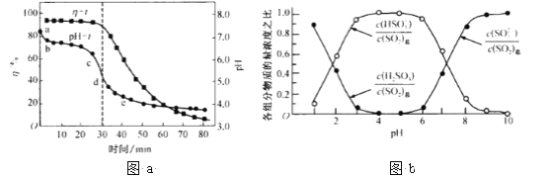
①已知纯ZnO的悬浮液 pH 约为6.8,判断在pH-t曲线cd 段发生的主要反应的离子方程式为____________。
②SO2的吸收效率η随 pH 降低而减小的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为
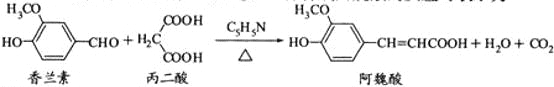
下列说法正确的是
A. 可用酸性![]() 溶液检测上述反应是否有阿魏酸生成
溶液检测上述反应是否有阿魏酸生成
B. 香兰素、阿魏酸均可与![]() 、
、![]() 溶液反应
溶液反应
C. 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D. 与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学课上围绕浓硫酸的化学性质进行了如下实验探究,将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。
请回答下列问题:
(1)生成的黑色物质(单质)是_____(填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是_______(填化学式),反应的化学方程式为_________。
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有___________(填序号)。
A.酸性 | B.吸水性 | C.脱水性 | D.强氧化性 |
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液_______,说明这种气体具有_______性;将(2)中产生的有刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式:__________________________________________。
(5)能否用澄清石灰水鉴别这两种气体?_______(填“能”或“不能”),若不能,请填写两种能鉴别的试剂____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)在常温常压下为有臭鸡蛋气味的无色气体,广泛应用于农药、医药和其他化工生产中,存在于煤、石油和天然气中的羰基硫会腐蚀设备、污染环境,更会危害人体健康,工业上处理羰基硫常见的方法有水解反应和氢解反应。
(1)已知羰基硫中所有原子最外层均达到8电子结构,则其结构式为________________。
(2)①已知:H2(g)+COS(g)![]() H2S(g)+CO(g)△H1=+6.2kJ·mol-1;
H2S(g)+CO(g)△H1=+6.2kJ·mol-1;
②H2(g)+CO2(g)![]() H2O(g)+CO(g)△H2=+41.2kJ·mol-1;
H2O(g)+CO(g)△H2=+41.2kJ·mol-1;
则COS水解反应的热化学方程式为H2O(g)+COS(g)=H2S(g)+CO2(g),△H=___________kJ/mol.
②已知:COS水解反应的机理如下,其中吸附在催化剂表面的物种用*标注。
a. 吸附:H2O→H2O*
b. 反应:COS+H2O*→CO2+H2S*
c. 脱附:H2S*→H2S
已知COS水解反应的反应速率由b决定,则a、b、c三步中活化能最大的是__________________。
(3)已知COS氢解反应的热化学方程式为H2(g)+COS(g)![]() H2S(g)+CO(g) △H=+6.2kJ·mol-1,一定温度下,向某恒容密闭容器中充入4molCOS(g)和6molH2(g)发生氢解反应,H2、COS的体积分数
H2S(g)+CO(g) △H=+6.2kJ·mol-1,一定温度下,向某恒容密闭容器中充入4molCOS(g)和6molH2(g)发生氢解反应,H2、COS的体积分数![]() 随时间变化的关系如图所示,
随时间变化的关系如图所示,
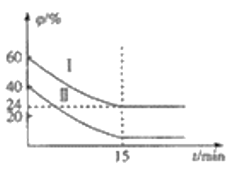
①H2的平衡转化率为_________________,
②该温度下,反应的平衡常数K为__________________,
③其他条件不变,20min时,向该容器中充入2molH2和3molCO,此时v(正)______________v(逆)(填“大于”“小于”或“等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com