

| A、原子半径:Z>Y>X |
| B、气态氢化物的稳定性:W>R |
| C、WX3和水反应形成的化合物是离子化合物 |
| D、Y和Z两者最高价氧化物对应的水化物能相互反应 |


科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
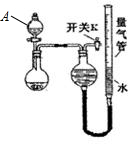
| 编号 | 粉末质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 2.0g | 10.0mL | 346.2mL |
| ② | 2.0g | 10.0mL | 335.0mL |
| ③ | 2.0g | 10.0mL | 345.8mL |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图中“过量的金属”可以是Na、Mg或Fe |
| B、反应开始时的速率:v(H2SO4)>v(HCl)>v(HAc) |
| C、最终得到氢气的体积:V H2SO4(H2)=VHCl(H2)=VHAc(H2) |
| D、所选用量筒的规格决定于金属的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用图装置进行下列实验,能得出相应实验结论的是( )
利用图装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 浓盐酸 | MnO2 | NaOH溶液 | 制氯气并吸收尾气 |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、 氧化性 |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 |
| D | 浓硝酸 | Na2CO3 | Na2SiO3 溶液 | 酸性:硝酸>碳酸 >硅酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.8mol?L-1 |
| B、1.0mol?L-1 |
| C、1.2mol?L-1 |
| D、2.0mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO、NO、NaH、N2 |
| B、SO2、NO2+、N3-、CNO- |
| C、CO32-、NO3-、BeCl2 |
| D、SiF4、SiO44-、SO42-、PO43- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com