
【题目】碳酸盐燃料电池,以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为3:1)直接作燃料,其工作原理如图所示,并以此电源用于工业生产。
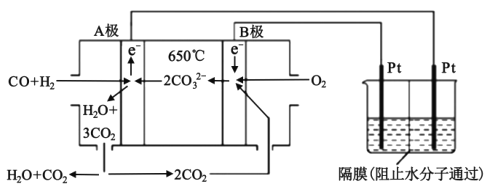
(1)H2(g)、CO(g)的燃烧热△H分别为-285.8kJmol-1、-283.0kJmol-1,18g液态水变为水蒸气时吸热44.0kJ,则电池总反应3CO(g)+H2(g)+2O2(g)=3CO2(g)+H2O(g)的△H=___kJmol-1,B电极上发生反应的电极反应式为___。
(2)若以此电源生产新型硝化剂N2O5,装置如图所示。已知两室加入的试剂分别是a.硝酸溶液;b.N2O4+无水硝酸,则左室加入的试剂应为___(填“a”或“b”),其电极反应式为___。
(3)若以此电源用惰性电极电解足量的硝酸银溶液,阴极产物的质量为5.4g,则阳极产生的气体在标准状况下的体积为___L。电解后溶液体积为500mL,溶液的pH约为___。
【答案】-1090.8 2CO2+O2+4e-=2CO32- b N2O4+2HNO3-2e-=2N2O5+2H+ 0.28 1
【解析】
(1)结合已知条件书写热化学方程式,根据盖斯定律计算;该装置为燃料电池,通入燃料的一极为负极,通入氧气的一极为正极,则A为负极,B为正极,B电极上氧气和二氧化碳得电子,发生还原反应;
(2)先根据化合价判断生成N2O5的电极,再根据离子的放电顺序写出电极反应式;
(3)依据消耗的氧气的量计算转移电子数,依据转移电子守恒,计算生成银的质量,根据消耗氢氧根计算氢离子浓度,从而计算pH。
(1)已知:H2(g)、CO(g)的燃烧热△H分别为-285.8kJmol-1、-283.0kJmol-1,18g液态水为1mol,变为水蒸气时吸热44.0kJ,则热化学方程式分别为:
①H2(g)+![]() O2(g)=H2O(1) △H=-285.8 kJ/mol
O2(g)=H2O(1) △H=-285.8 kJ/mol
②CO(g)+![]() O2(g)=CO2(g) △H=-283kJ/mol
O2(g)=CO2(g) △H=-283kJ/mol
③H2O(1)=H2O(g) △H=+44kJ/mol
根据盖斯定律,②×3+①+③可得:3CO(g)+H2(g)+2O2(g)=3CO2(g)+H2O(g)△H=-1090.8kJmol-1;该装置为燃料电池,通入燃料的一极为负极,通入氧气的一极为正极,则A为负极,B为正极,B电极上氧气和二氧化碳得电子,发生还原反应,电极反应式为2CO2+O2+4e-=2CO32-;
(2)N2O5中氮元素的化合价是+5价,而硝酸中氮元素也是+5价,若只有硝酸作电解液的电极室生成N2O5未发生氧化还原反应,由于N2O4中N为+4价,则含有N2O4的电极室电解后产生N2O5,氮元素的化合价由+4价变为+5价,发生氧化反应,该电极室作阳极,应与电源正极相连,根据(1)中分析,A为负极,因此应该在左侧生成N2O5,则左侧室应加入试剂b;其电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+;
(3)电解足量的硝酸银溶液,阳极为氢氧根失电子生成氧气,阴极上发生反应:Ag++e=Ag,产物的质量为5.4g,即![]() =0.05mol,转移电子是0.05mol,在阳极上:4OH4e=2H2O+O2↑,产生氧气的物质的量是0.0125mol,标况下的体积是0.0125mol×22.4L/mol= 0.28L,则消耗氢氧根的物质的量为0.05mol,则溶液中氢离子为0.05mol,浓度为
=0.05mol,转移电子是0.05mol,在阳极上:4OH4e=2H2O+O2↑,产生氧气的物质的量是0.0125mol,标况下的体积是0.0125mol×22.4L/mol= 0.28L,则消耗氢氧根的物质的量为0.05mol,则溶液中氢离子为0.05mol,浓度为![]() =0.1mol/L,所以溶液的pH为1。
=0.1mol/L,所以溶液的pH为1。


科目:高中化学 来源: 题型:
【题目】在一定条件下,反应A(g)+B(g) ![]() C(g)(正反应为放热反应)达到平衡后,根据下列图像判断:
C(g)(正反应为放热反应)达到平衡后,根据下列图像判断:
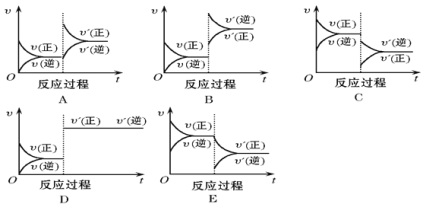
(1)升温,达到新平衡的是________,新平衡中C的体积分数________(填“增大”、“减小”或“不变”,下同)。
(2)降压,达到新平衡的是________,A的转化率________。
(3)减少C的量,达到新平衡的是_______。
(4)增加A的量,达到新平衡的是____,此时B的转化率________,A的转化率________。
(5)使用催化剂,达到平衡的是________, C的质量分数________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟"人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
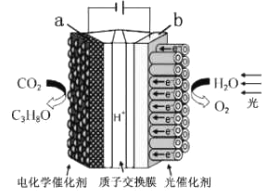
A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1 mol O2,有44 gCO2被还原
D. a电极的反应为:3CO2+ 16H+-18e-= C3H8O+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
A.电池的电解质溶液为碱性溶液,阳离子向正极移动
B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸(H3BO3)及轻质氧化镁的工艺流程如下:
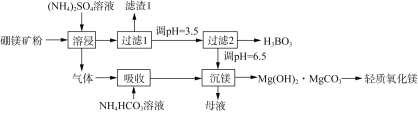
回答下列问题:
(1)“溶浸”硼镁矿粉过程中,提高B、Mg元素的浸出率可以采用什么措施________(填写两点)。
(2)“溶浸”后产生的气体是__________(填化学式)。
(3)为检验“过滤1”后的滤液中是否含有Fe3+,可选用的化学试剂是______________溶液(填化学式)。
(4)根据H3BO3的解离反应:H3BO3+H2O![]() H++B(OH)4,Ka=5.81×10-10,写出H3BO3与NaOH反应的离子方程式________________________________________。
H++B(OH)4,Ka=5.81×10-10,写出H3BO3与NaOH反应的离子方程式________________________________________。
(5)写出“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式以及将碱式碳酸镁高温灼烧制备轻质氧化镁的化学方程式________________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌的配合物[Zn(NH3)4]2+、ZSM、[Zn(N2H4)2(N3)2] n等用途非常广泛。
(1)Zn2+基态核外电子排布式为________________________。
(2)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配体NH3分子属于________(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键___________。

(3)ZSM是2-甲基咪唑和水杨酸与锌形成的配合物,2-甲基咪唑可通过下列反应制备:

①与CN-互为等电子体的分子是____________(填化学式,写两种)。
②2-甲基咪唑中碳原子杂化轨道类型为________;1 mol 2-甲基咪唑分子中含σ键和π键之比为________。
③乙二胺易溶于水的主要原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用电化学方法以SO2和Na2SO3为原料制取硫酸的装置如图所示(A、B为多孔石墨电极,C、D为惰性电极)。下列说法错误的是( )

A.“膜2”为阳离子交换膜
B.电极A的电极反应为SO2-2e-+2H2O==SO42-+4H+
C.上述过程中,亚硫酸钠溶液可循环使用
D.使用该装置制取98g硫酸需消耗11.2L O2(STP)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com