
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)H2(g)+CO2(g).在500℃时,平衡常数K=9.若反应开始时,一氧化碳和水蒸气的浓度都是0.02mol/L,则在此条件下CO的转化率为( )
A.25%
B.50%
C.75%
D.80%
科目:高中化学 来源: 题型:
【题目】苯乙烯,简称SM,是石化行业的重要基础原料,主要用于生产苯乙烯系列树脂及丁苯橡胶。苯乙烯能发生如下一系列变化。下列说法不正确的是

A. 有机物SM能使溴的四氯化碳溶液褪色
B. 有机物I能与金属钠反应放出H2
C. 有机物I、II均能发生氧化反应和加成反应
D. 有机物I的同分异构体中,苯环上只有一个烃基且含有碳碳双键的结构有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某食用白醋是由醋酸与纯水配制而成,用中和滴定的方法准确测定其中醋酸的物质的量浓度.实验步骤:①配制500mL浓度约为0.1molL﹣1的NaOH溶液;②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度;③用已知准确浓度的NaOH溶液测定醋酸的浓度.
(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解.该配制步骤(填“可行”或“不可行”).
(2)称量时NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期(填“小”或“大”),这是不能直接配制其标准溶液的原因.
(3)查阅白醋包装说明,醋酸含量约为6g/100mL,换算成物质的量浓度约为 molL﹣1 , 滴定前将白醋稀释(填“10”或“100”)倍.(已知醋酸的相对分子质量为60)
(4)稀释白醋时需要的仪器有烧杯、玻璃棒、滴管、酸式滴定管、 .
(5)准确量取稀释后的白醋20.00mL,置于250mL锥形瓶中,加水30mL,再滴加酚酞指示剂,用上述NaOH标准溶液滴定至即为终点. 重复滴定两次,平均消耗NaOH标准溶液V mL(NaOH溶液浓度为c molL﹣1).
(6)原白醋中醋酸的物质的量浓度=molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华传统文化博大精深,其中涉及到很多的化学知识。下列有关说法不正确的是
A. “滴水石穿、绳锯木断”不包含化学变化
B. 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料
C. “落汤螃蟹着红袍”肯定发生了化学变化
D. 中国蓝是古代人工合成的蓝色化合物,其化学式为BaCuSi4O10,可改写成BaO·CuO·4SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某气态烃的摩尔质量为16g/mol,该烃中氢元素的质量分数为25% ,则该烃的分子式为_______________结构式为________ ,空间构型为__________ ,在光照条件下该烃和氯气反应生成气态有机物的反应方程式为___________________________________________ ,反应类型为 _________
(2)化学式为C8Hm的烷烃,m值等于______;CnH22的烷烃,n值等于_______;相对分子质量为212的烷烃的分子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8 kJ/mol
N2(g) + 2O2(g)= 2NO2(g) △H= +133 kJ/mol
H2O(g) =H2O(l) △H=- 44 kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为_____________。
Ⅱ.脱碳:
(1)向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l)。下列叙述能说明此反应达到平衡状态的是__________________。
CH3OH(l) + H2O(l)。下列叙述能说明此反应达到平衡状态的是__________________。
A.混合气体的平均式量保持不变 B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等 D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H—H键断裂
(2)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应CO(g) + 2H2(g) ![]() CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与
CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与![]() 的关系如图所示。
的关系如图所示。
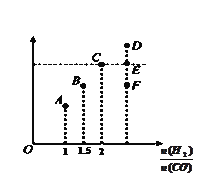
①当起始![]() =2,经过5min达到平衡,CO的转化率为0.4,则0~5min内平均反应速率V(H2)=___________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将__________(选填“增大”、“减小”或“不变”);
=2,经过5min达到平衡,CO的转化率为0.4,则0~5min内平均反应速率V(H2)=___________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将__________(选填“增大”、“减小”或“不变”);
②当起始![]() =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___________点(选填“D”、“E”或“F”)
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___________点(选填“D”、“E”或“F”)
Ⅲ.脱硫:
如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_____________,阴极的电极反应式是________________________。
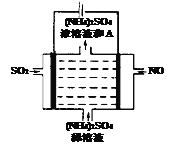
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究影响化学反应速率的外界因素,进行以下实验。
(1)向100mL稀硫酸中加入过量的锌粉,标准状况下测得数据累计值如下:
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
①在0~1、1~2、2~3、3~4、4~5min各时间段中:
反应速率最大的时间段是________min,主要的原因可能是_____________________;
反应速率最小的时间段是________min,主要的原因可能是_____________________。
②为了减缓反应速率但不减少产生氢气的量,可以在稀硫酸中加入________(填序号)。
a.蒸馏水 b.NaOH溶液 c.NaNO3溶液 d.Na2CO3溶液
(2)进行以下对比实验并记录实验现象。
实验 Ⅰ
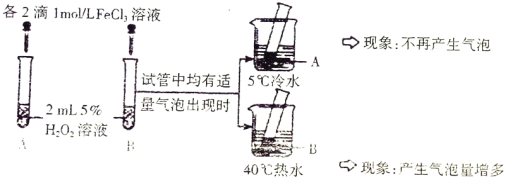
实验 Ⅱ:另取两支试管分别加入5mL5%eH2O2溶液和5mL10%H2O2溶液,均未观察到有明显的气泡
产生。
①双氧水分解的化学方程式是________________。
②实验 Ⅰ 的目的是______________。
③实验 Ⅱ 未观察到预期现象,为了达到该实验的目的,可采取的改进措施是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com