
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| C(NO)/mol•L-1 | 9.50×10-3 | 4.50×10-3 | 2.50×10-5 | 1.50×10-3 | 1.5×10-3 |
| C(CO)/mol•L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
| A. | -定温度下,从开始到平衡,该反应的平衡常数逐渐增大 | |
| B. | 前2s内的平均反应速率v(N2)=1.75×10-3 mol•L-1•s-1 | |
| C. | 达到平衡时,CO的转化率为11.11% | |
| D. | 3s时NO和CO的浓度都不再变化,反应停止进行 |
分析 A.温度不变,平衡常数不变;
B.前2s内△c(CO)=7.00×10-3mol/L,则△c(N2)=3.50×10-3mol/L,结合v=$\frac{△c}{△t}$计算;
C.达到平衡时,CO的浓度为1.00×10-3mol/L,可知△c(CO)=8.00×10-3mol/L,由此可计算转化率;
D.NO和CO的浓度都不再变化,反应达到平衡状态.
解答 解:A.平衡常数只受温度的影响,温度不变,平衡常数不变,故A错误;
B.前2s内△c(CO)=7.00×10-3mol/L,则△c(N2)=3.50×10-3mol/L,v(N2)=$\frac{3.5×1{0}^{-3}mol/L}{2s}$=1.75×10-3 mol•L-1•s-1,故B正确;
C.达到平衡时,CO的浓度为1.00×10-3mol/L,可知△c(CO)=8.00×10-3mol/L,则转化率=$\frac{8×1{0}^{-3}}{9×1{0}^{-3}}×100%$=88.9%,故C错误;
D.NO和CO的浓度都不再变化,反应达到平衡状态,但反应没有停止,故D错误.
故选B.
点评 本题考查化学平衡的计算,为高频考点,侧重考查学生的分析能力和计算能力,注意把握平衡常数的意义以及平衡状态的特点,把握题给数据的分析,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl的反应 | B. | NaOH溶液与盐酸的反应 | ||
| C. | 甲烷与氧气的反应 | D. | 石灰石的分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
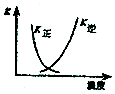 A.2SO2(g)+O2(g)?2SO3(g)△H<0 |  B.25℃时,用0.1mol/L盐酸滴定20mL0.1mol/LNaOH溶液 |
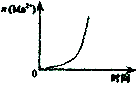 C.酸性KmnO4溶于与过量的H2C2O4溶液混合 |  D.CH2=CH2(g)+H2(g)→CH3CH3(g)△H>0,使用催化剂(a)和未使用催化剂(b) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X和Y只能形成一种化合物 | |
| B. | 原子半径:r(Z)>r(W)>r(Y) | |
| C. | W的简单气态氢化物的热稳定性比Y强 | |
| D. | 元素Z、W的简单离子具有相同的电子层结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
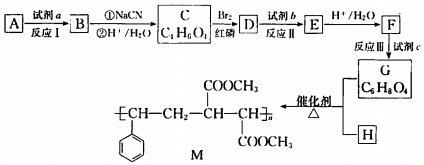
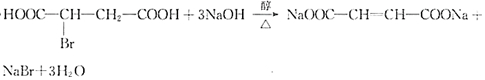 .
.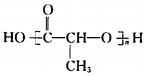 在该条件下,1mol N生成2mol I,N的结构简式是
在该条件下,1mol N生成2mol I,N的结构简式是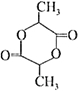 .
.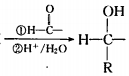 以苯和乙醛为原料制备H,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):
以苯和乙醛为原料制备H,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):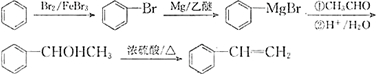 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
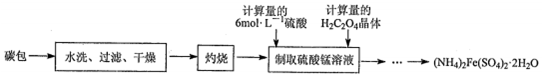
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉使某些有色染料褪色 | |
| B. | 一氧化氮气体暴露在空气中变为红棕色 | |
| C. | 往黄色氯化铁溶液中投入铁粉,溶液颜色变浅 | |
| D. | 往红墨水中投入活性炭,红色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作或现象 | 结论 |
| A | 向含有NaOH的Mg(OH)2悬浊液中滴加CoCl2溶液,产生粉色沉淀 | KSP[Co(OH)2]<KSP[Mg(OH)2] |
| B | 将铁粉和铜粉分别和硫粉混合加热,分别生成FeS、Cu2S | 还原性:Fe>Cu |
| C | 在透明溶液中通入CO2,产生白色胶状物质 | 原溶液含有SiO32- |
| D | 控制其它条件相同,在过氧化氢中分别加入等量的氯化铁和氯化铜做催化剂,加入氯化铁的产生气泡速率更快 | 其它条件相同时,Fe3+对过氧化氢分解的催化作用强于Cu2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com