
分析 (1)浓度均为0.1mol•L-1的BaCl2溶液与Na2SO4溶液等体积混合,Qc=0.1mol/L×$\frac{1}{2}$×0.1mol/L×$\frac{1}{2}$=2.5×10-3>Ksp=1×10-10,可知生成BaSO4沉淀;
(2)BaSO4的Ksp=1×10-10,c(Ba2+)=$\frac{Ksp(BaS{O}_{4})}{c(S{{O}_{4}}^{2-})}$,以此来解答.
解答 解:(1)浓度均为0.1mol•L-1的BaCl2溶液与Na2SO4溶液等体积混合,Qc=0.1mol/L×$\frac{1}{2}$×0.1mol/L×$\frac{1}{2}$=2.5×10-3>Ksp=1×10-10,可知生成BaSO4沉淀,钡离子沉淀完全,充分搅拌后过滤,滤液中c(Ba2+)=1×10-5mol•L-1,
故答案为:1×10-5;
(2)BaSO4的Ksp=1×10-10,用大量0.5mol•L-1Na2SO4溶液给患者洗胃,忽略洗胃过程中Na2SO4溶液浓度的变化,c(Ba2+)=$\frac{Ksp(BaS{O}_{4})}{c(S{{O}_{4}}^{2-})}$=$\frac{1×1{0}^{-10}}{0.5}$=2×10-10mol/L,
故答案为:2×10-10.
点评 本题考查难溶电解质的生成,为高频考点,把握Ksp的计算及应用、沉淀生成的判断为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
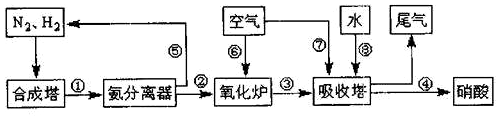
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 25 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 20 | 0.152 |

查看答案和解析>>
科目:高中化学 来源: 题型:推断题

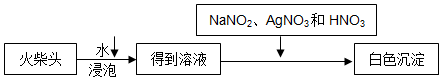
 ,D与E反应的现象是有白烟生成;D在催化剂作用下被氧气氧化是工业制备硝酸的主要反应之一,已知1molD被催化氧化生成气态物质放出aKJ的热量,请写出该反应的热化学反应方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H=-4akJ/mol.
,D与E反应的现象是有白烟生成;D在催化剂作用下被氧气氧化是工业制备硝酸的主要反应之一,已知1molD被催化氧化生成气态物质放出aKJ的热量,请写出该反应的热化学反应方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H=-4akJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该分散系的分散质为Fe2O3 | |
| B. | 可用过滤的方法将黑色金属氧化物与Na+分离开 | |
| C. | 向沸水中逐滴滴加0.1 mol/L FeCl3溶液也可得到Fe(OH)3胶体 | |
| D. | 加入NaOH溶液时发生的反应可能为:Fe2++2Fe3++8OH-═Fe3O4+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
 | ① | 0.2mol/LNa2SO3溶液 | 品红溶液 | 红色消失 |
| ② | 饱和Ag2SO4浊液 | 产生白色沉淀 | ||
| ③ | 0.2mol/L CuSO4溶液 | 溶液先变绿,继续滴加产生砖红色沉淀 | ||
| ④ | 0.lmol/L Al2(SO4)溶液 | 开始无明显现象,继续滴加产生白色沉淀,并有刺激性气味的气体生成 |
| A. | Na2SO3溶液具有漂白性 | |
| B. | Ksp(Ag2SO4)<Ksp(Ag2SO3) | |
| C. | 实验③,SO32-与Cu2+发生了氧化还原反应 | |
| D. | 实验④发生反应的离子方程式为:3SO32-+2Al3++3H2O═2Al(OH)3↓+3SO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下铝与浓硫酸不发生反应,故常温下可用铝制容器贮运浓硫酸 | |
| B. | 碳酸钠可与盐酸反应,故常用于治疗胃溃疡病人的胃酸过多症 | |
| C. | 氧化铝具有很高的熔点,故可用于制造阻燃剂或耐高温材料 | |
| D. | 二氧化硫、潮湿的氯气均具有漂白性,故其混合物的漂白效果会更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性随原子电子层数的增加而增加 | |
| B. | 在空气中燃烧的生成物都是过氧化物 | |
| C. | 与水反应的剧烈程度随核电荷数增加而增强 | |
| D. | 最高价氧化物对应水化物的碱性随核电荷数增加而增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com