
【题目】如图所示,A为电源,B为浸透饱和食盐水和酚酞溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液如图所示。
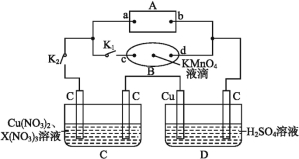
(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源b端为 极,通电一段时间后,滤纸d端的电极反应式是 。
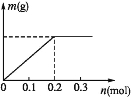
(2)已知C装置中溶液的溶质为Cu(NO3)2和X(NO3)3,且均为0.1 mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+氧化能力由大到小的顺序是 。
(3)D装置中溶液是H2SO4溶液,则电极C端从开始至一段时间后的实验现象是 。
【答案】
(1)负极,2H+ + 2e- = H2
(2)Cu2+ >H+ >X3+
(3)产生无色气体,溶液变为蓝色,一段时间后有红色物质析出
【解析】
试题分析:(1)据题意B的KMnO4紫红色液滴向c端移动,说明高锰酸根离子向c端移动,可推出极c端为阳极,则与之相连的电源a端为正极,b端为负极,所以通电滤纸d端为阴极,电极反应式为2H++2e-=H2↑,故答案为:负;2H++2e-=H2↑;
(2)根据电解C的图象可知,通电后就有固体生成,当通过电子为0.2mol时,析出固体质量达最大,证明此时析出的固体是铜.如果是X3+析出,电子数应该是0.3mol,则氧化能力为Cu2+>X3+,当电子超过0.2mol时,固体质量没变,说明这是阴极产生的是氢气,即电解水,说明氧化能力H+>X3+,故氧化能力为Cu2+>H+>X3+;故答案为:Cu2+>H+>X3+;
(3)D装置中溶液是H2SO4,电极C端与b负极相连即为阴极,开始为氢离子得电子生成氢气,后阳极的铜失电子生成铜离子进入溶液,溶液变为蓝色,一段时间后有红色物质在阴极析出,所以看到的现象为在C端开始时有无色无味气体产生,溶液变为蓝色,一段时间后有红色物质析出;故答案为:在C端开始时有无色无味气体产生,溶液变为蓝色,一段时间后有红色物质析出。


科目:高中化学 来源: 题型:
【题目】在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
(1)①该反应的平衡常数表达式为:K= 。
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速为 。
(2)说明该反应已达到平衡状态: 。
A.CO或(CO2)的生成速率与消耗速率相等
B.CO(或CO2)的质量不再改变
C.CO(或CO2)的体积分数50%
(3)I2O5可使H2S、CO、HCl等氧化,常用于定量测定CO的含量.已知:
I2(s)+5O2(g)=2I2O5(s) △H1=-75.56kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
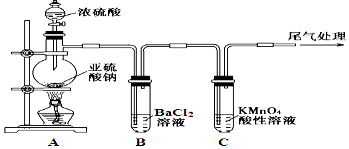
已知:Na2SO3+H2SO4(浓)![]() Na2SO4+SO2↑+H2O,请回答下列问题:
Na2SO4+SO2↑+H2O,请回答下列问题:
(1) 装置A中盛放浓硫酸的仪器名称是 。
(2) 实验过程中,C中的现象是 ,说明SO2具有 性。
(3) 实验过程中,观察到装置B中出现了明显的白色沉淀。为探究该白色沉淀的成分,该小组同学进行了如下实验:
![]()
根据实验事实判断该白色沉淀的成分是 (填化学式),产生该白色沉淀的原因可能是 (填字母编号)。
a.BaSO3既不溶于水也不溶于酸
b.BaCl2溶液中可能溶解有氧气
c.BaCl2溶液中可能混有NaOH
d.由A制得的SO2气体中可能混有氧气
(4)如果将装置A中的浓H2SO4换作浓HNO3,对此实验是否有影响并说明理由
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列四种物质分别加入到盛有100 mL蒸馏水的烧杯中,不能使蒸馏水导电性发生明显变化的是( )
A.10 g NaCl固体
B.10 g NaOH固体
C.10 g BaSO4固体
D.10 g Cu(NO3)2固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】属于工业固氮的是
A. N2与O2反应生成NO B. 由NH3转变成 NH4HCO3
C. N2与H2在一定条件下反应生成NH3 D. 豆科植物的根瘤吸收氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图为某实验小组依据氧化还原反应_______________(用离子方程式表示)设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差 12 g,导线中通过__________mol 电子。
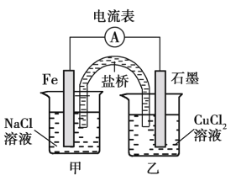
(2)其他条件不变,若将 CuCl2溶液换为 NH4Cl 溶液,石墨电极发生的电极反应为___________,这是由于 NH4Cl 溶液显_______________(填“酸性”、“碱性” 或“中性”)。用吸管吸出铁片附近的溶液少许置于试管中,向其中滴加少量新制饱和氯水,然后滴加几滴 KSCN 溶液,溶液变红,继续滴加过量新制饱和氯水,溶液颜色褪去,同学们对此做了多种假设,某同学的假设:“溶液中的+3 价铁被氧化为更高价态。” 如果+3 价铁被氧化为 FeO42-,写出发生反应的离子方程式___________________。
(3)其他条件不变,若将盐桥换成弯铜导线与石墨连成的形装置如图所示,一段时间后,在甲装置铜丝附近滴加酚酞溶液,现象是____________,电极反应为__________;乙装置中石墨(Ⅰ)为__________(填“正”、 “ 负” 、 “ 阴”或“阳”)极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,关于pH = 2的盐酸,下列说法不正确的是
A. 溶液中c(H+)=1.0ⅹ10-2mol·L-1
B. 此溶液中由水电离出的c(OH-)=1.0ⅹ10-12mol·L-1
C. 加水稀释100倍后,溶液的pH=4
D. 加入等体积pH=12的氨水,溶液呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com