合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生为:CH
4(g)+H
2O(g)?CO(g)+3H
2(g)△H
1=+206.1kJ/mol
请回答下列问题:
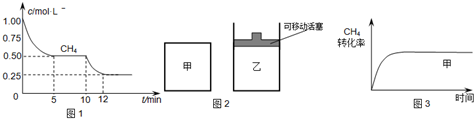
(1)在一密闭容器中进行反应①,测得CH
4的物质的量浓度随反应时间的变化如图1所示.反应中处于平衡状态的时间为______;10min时,改变的外界条件可能是______.
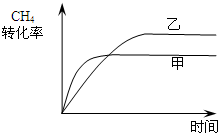
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH
4和CO
2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH
4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH
4的转化率随时间变化的图象.
(3)反应CO(g)+H
2O(g)?CO
2(g)+H
2(g)800℃时,反应的化学平衡常数K=1.0.
①某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时反应中正、逆反应速率的关系式是______(填代号).
a.v(正)>v(逆)b.v(正)<v(逆)c.v(正)=v(逆)d.无法判断
②800℃时,向体积为2L的密闭容器中充入2molCO和4molH
2O,求达到平衡时CO的转化率.


 ,
, ;
;

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案