
分析 (1)测定有机物相对分子质量的方法为质谱法;
(2)浓硫酸增重的为水的质量、碱石灰增重的为二氧化碳的质量,根据n=$\frac{m}{M}$计算出有机物、水和二氧化碳的物质的量,然后根据质量守恒定律确定其分子式;
(3)根据测定的核磁共振氢谱判断其结构简式,然后写出其在浓硫酸作用下加热发生消去反应的化学方程式;
(4)CH3CH(OH)CH3分子中含有羟基,能够发生酯化反应,根据酯化反应原理写出该反应的化学方程式.
解答 解:(1)通过质谱法可以测定出有机物的相对分子质量,故答案为:质谱法;
(2)6.0g该有机物的物质的量为:$\frac{6.0g}{60g/mol}$=0.1mol,
7.2g水的物质的量为:$\frac{7.2g}{18g/mol}$=0.4mol,含有H原子的物质的量为0.8mol,质量为:1g/mol×0.8mol=0.8g,
13.2g二氧化碳的物质的量为:$\frac{13.2g}{44g/mol}$=0.3mol,12g/mol×0.3mol=3.6g,
3.6g+0.8g=4.4g<6.0g,
则该有机物中一定含有氧元素,其物质的量为:$\frac{6.0g-4.4g}{16g/mol}$=0.1mol,
则该有机物分子中含有C、H、O原子的数目为:N(C)=$\frac{0.3mol}{0.1mol}$=3、N(H)=$\frac{0.8mol}{0.1mol}$=8、N(O)=$\frac{0.1mol}{0.1mol}$=1,
故该有机物分子式为:C3H8O,
故答案为:C3H8O;
(3)测定核磁共振氢谱,有三个强峰,比值为6:1:1,说明其分子中含有2个甲基,则该有机物的结构简式为:CH3CH(OH)CH3,其发生消去反应的化学方程式为:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O,
故答案为:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O;
(4)CH3CH(OH)CH3分子中含有羟基,能够发生酯化反应,CH3CH(OH)CH3与乙酸发生酯化反应的化学方程式为:CH3COOH+HO-CH(CH3)2$→_{△}^{浓硫酸}$CH3COOCH(CH3)2+H2O,
故答案为:CH3COOH+HO-CH(CH3)2$→_{△}^{浓硫酸}$CH3COOCH(CH3)2+H2O.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | NaCl分散在无水酒精中,形成的分散系是胶体 | |
| B. | 胶体区别于其他分散系的本质特征是丁达尔效应 | |
| C. | 胶体带电荷,而溶液呈电中性 | |
| D. | 在胶体中通电时,分散质微粒一定向某一极移动,在溶液中通电时,溶质微粒一定向两极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | VIA | ⅥA | O族 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物. ,该化合物是由极性(填“极性”或“非极性”)键形成的.
,该化合物是由极性(填“极性”或“非极性”)键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
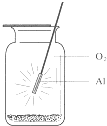
| A. | 铝条应始终置于集气瓶瓶口位置 | |
| B. | 迅速将铝条插入集气瓶接近瓶底位置 | |
| C. | 将铝条从瓶口位置慢慢伸向瓶底位置 | |
| D. | 铝条应不断上下移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 此法对环境不会造成任何污染 | |
| B. | 沉降、过滤、洗涤沉淀物操作中既有物理变化也有化学变化 | |
| C. | 若提取12 kg Mg,则电子转移1 000 mol | |
| D. | 以上提取镁的过程涉及的离子反应共有3个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
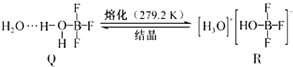
| A. | 离子键 | B. | 共价键 | C. | 配位键 | D. | 氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40g NaOH溶解在1L 水中 | |
| B. | 将22.4LHCl气体溶于水配成1L溶液 | |
| C. | 将1 L10mol•L-1的浓盐酸加入9L水中 | |
| D. | 将10gNaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com