
 ��ϩ����ֱ��ˮ�Ϸ�Ӧ��������������ͬʱ���ֱ���C2H4��ƽ��ת�����ڲ�ͬѹǿ��P1��P2�������¶ȱ仯��������ͼ��������߹���ƽ��ת����
��ϩ����ֱ��ˮ�Ϸ�Ӧ��������������ͬʱ���ֱ���C2H4��ƽ��ת�����ڲ�ͬѹǿ��P1��P2�������¶ȱ仯��������ͼ��������߹���ƽ��ת�������� ��ͼ��������º���ѹ�ֱ��ж�C2H4��ƽ��ת���ʱ仯��
��1�������ϩ��ת���ʣ�����ʹƽ�������ƶ���������������ϩ������
��2����������ʹ�����֮�䷴Ӧ�����Ȼ��ƺʹ��ᣬ��Һ��ʾ���ԣ����Դ����ƻ�ʣ�࣬c��H+��=c��OH-��=10-7mol/L����c��Cl-��=0.5bmol/L�����ݵ���غ�c��CH3COO-��+c��Cl-��=c��Na+��=0.5amol/L������c��CH3COO-��=��0.5a-0.5b��mol/L���ƽ�ⳣ��Ka=$\frac{c��CH{\;}_{3}COO{\;}^{-}��•c��H{\;}^{+}��}{c��CH{\;}_{3}COOH��}$���㣻
��3���ٸ���ƽ�ⳣ��K=$\frac{c��CO{\;}_{2}��}{c��CO��}$������м��㣻
�ڸ�������ʽ���ݽ��K=$\frac{c��CO{\;}_{2}��}{c��CO��}$�����з��̼��㣮
��� �⣺��a����ͼ���֪�������¶ȣ�ƽ�������ƶ���C2H4��ƽ��ת���ʽ��ͣ�
�ʴ�Ϊ������������ͬ���¶����ߣ�C2H4��ƽ��ת���ʽ��ͣ�
��b����ӦC2H4 ��g��+H2O��g��?C2H5OH��g��Ϊ���������С�ķ�Ӧ������ѹǿ��ƽ�������ƶ���C2H4��ƽ��ת��������
�ʴ�Ϊ������������ͬ������ѹǿ��C2H4��ƽ��ת��������
��1��A��������ϩ��Ũ�ȣ���ϩ��ת���ʼ�С����A����
B��������Ҵ���ƽ�������ƶ�����ϩ��ת��������B��ȷ��
C���Ӵ�������Ӱ�컯ѧƽ�⣬��ϩ��ת���ʲ��䣬��C����
D����С���������������ѹǿ��C2H4��ƽ��ת��������D��ȷ��
�ʴ�Ϊ��BD��
��2������ʹ�����֮�䷴Ӧ�����Ȼ��ƺʹ��ᣬ��Һ��ʾ���ԣ����Դ����ƻ�ʣ�࣬c��H+��=c��OH-��=10-7mol/L����c��Cl-��=0.5bmol/L�����ݵ���غ�c��CH3COO-��+c��Cl-��=c��Na+��=0.5amol/L������c��CH3COO-��=��0.5a-0.5b��mol/L��
����ĵ��볣��Ka=$\frac{c��CH{\;}_{3}COO{\;}^{-}��•c��H{\;}^{+}��}{c��CH{\;}_{3}COOH��}$=$\frac{\frac{a-b}{2}��10{\;}^{-7}}{\frac{b}{2}}$=$\frac{10{\;}^{-7}��a-b��}{b}$���ʴ�Ϊ��$\frac{10{\;}^{-7}��a-b��}{b}$��
��3����K=$\frac{c��CO{\;}_{2}��}{c��CO��}$��ƽ�ⳣ��K=0.25��n��CO����n��CO2��=$\frac{1}{0.25}$����n��CO����n��CO2��=4��1���ʴ�Ϊ��4��1��
��ͨ��x mol CO��t��ʱ��Ӧ�ﵽƽ�⣮��ʱFeO��s��ת����Ϊ50%������Ӧ��FeOΪ0.02mol��50%=0.01mol����
FeO��s��+CO��g��?Fe��s��+CO2��g��
��ʼʱ���ʵ�����mol�� 0.02 x 0 0
�仯�����ʵ�����mol�� 0.02��50% 0.01 0.01 0.01
ƽ��ʱ���ʵ�����mol�� 0.01 x-0.01 0.01 0.01
����ƽ�ⳣ��K=$\frac{c��CO{\;}_{2}��}{c��CO��}$=$\frac{0.01}{x-0.01}$=0.25�����x=0.05��
�ʴ�Ϊ��0.05mol��
���� ���⿼����ۺϣ��漰��ѧƽ����㡢��ѧƽ���ƶ�Ӱ�����صȣ�Ϊ��Ƶ���㣬���ط������������������Ŀ��飬���ջ�ѧ��Ӧԭ����ͼ�����̵ķ���Ϊ���Ĺؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  �������� | B�� |  ������������ | C�� |  ʵ��������ϩ | D�� |  ʯ�͵����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ˮ�ܸ��Ȼ�������Һ��Ӧ�������������� | |
| B�� | ��������ֽ� | |
| C�� | 0.1mol/L�İ�ˮ����ʹ��̪��Һ��� | |
| D�� | 0.1mol/L��NH4Cl��Һ��pHԼΪ5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | X�Լ�����Na2SO3������Һ | |
| B�� | ���������ӷ�Ӧ��2Br-+Cl2�T2Cl-+Br2 | |
| C�� | ��ҵ��ÿ���1molBr2����Ҫ����Cl244.8L | |
| D�� | �����������ȡ����Һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��A�Ķ���ȡ������1�֣�
��A�Ķ���ȡ������1�֣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
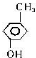 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��HCOO-����c��Na+�� | B�� | c��HCOOH����c��HCOO-�� | ||
| C�� | c��HCOOH��+c��HCOO-��=0.02mol•L-1 | D�� | 2c��H+��+c��HCOOH��=c��HCOO-��+2c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ѹǿ | B�� | ���������ܶ� | ||
| C�� | 3v����C��=2v����B�� | D�� | �����ƽ����Է������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | �� | C�� | ������Һ | D�� | �ơ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com