
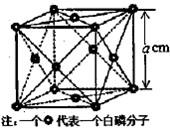
 氮族元素包括N、P、As、Sb和Bi五种元素.
氮族元素包括N、P、As、Sb和Bi五种元素.| 1 |
| 8 |
| 1 |
| 2 |
| ||
| a3 |
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| a3 |
| 4×31×4 |
| ρa3 |
| 496 |
| ρa3 |
| 496 |
| ρa3 |


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:

| A、能与溴水发生氧化反应,使溴水褪色 |
| B、能使酸性KMnO4溶液褪色 |
| C、能发生聚合反应 |
| D、能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
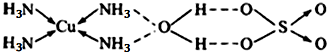
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ? | |
查看答案和解析>>
科目:高中化学 来源: 题型:
 金属及其化合物在生活、科研、生产中有着重要的作用.
金属及其化合物在生活、科研、生产中有着重要的作用.| 放电 |
| 充电 |
| c(Ca2+) |
| c(Mn2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将滴定管洗净,再用蒸馏水润洗后,即可注入标准液进行滴定 |
| B、粗略配制浓度为2mol?L-1的NaCl溶液,可将58.5g NaCl加入到盛有500mL水的烧杯中,搅拌、溶解 |
| C、向乙酸乙酯中加入稀NaOH溶液,振荡,分液,可除去乙酸乙酯中的少量乙酸 |
| D、为验证氯仿中含有的氯元素,可向氯仿中加入NaOH溶液,加热充分反应后,再加入AgNO3,观察到白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com