
 .C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为sp3
.C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为sp3
分析 A的基态原子外围电子排布式为3s2,则A为镁元素,B原子的L电子层的P能级上有一个空轨道,则B为碳元素,C元素的基态原子最外层有3个未成对电子,次外层有2个电子,则C为氮元素,D 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反,则D为氧元素,E是海水中除氢、氧元素外含量最多的元素,则E为氯元素,F和G在周期表中既处于同一周期又位于同一族,说明F和G都位于第ⅤⅢ族,原子序数F比G小2,且都小于36,所以F为铁元素,G为镍元素,以此来解答.
解答 解:(1)C为氮元素,它的外围电子排布图为  ,C与氢元素的阳离子为铵根离子,中心原子氮的价层电子对数为$\frac{5+3}{2}$=4,所以氮原子的杂化类型为sp3杂化,故答案为:
,C与氢元素的阳离子为铵根离子,中心原子氮的价层电子对数为$\frac{5+3}{2}$=4,所以氮原子的杂化类型为sp3杂化,故答案为: ;sp3;
;sp3;
(2)AE2为MgCl2,用电子式表示MgCl2的形成过程为 ,
,
故答案为: ;
;
(3)F(BD)5为Fe(CO)5,因为Fe(CO)5化合价的代数和为0,CO的化合价的代数和为0,则Fe元素的化合价为0,故答案为:0;
(4)Cl有多种含氧酸根①ClO-②ClO2-③ClO3-④ClO4-,中心原子Cl的价层电子对数都为$\frac{7+1}{2}$=4,氯原子都是按sp3方式杂化的,其中只有ClO4-,有四个Cl-O键,没有孤电子对,其空间构型为四面体型,其它含氧酸根都有孤电子对,空间构型不为四面体,故答案为:④;
(5)C 的最高价氧化物对应的水化物与A 的单质反应时,C被还原到最低价,生成硝酸铵,该反应的化学方程式为4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O,
故答案为:4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O.
点评 本题考查原子结构与元素周期律,为高频考点,把握电子排布、元素的位置来推断元素为解答的关键,侧重分析与应用能力的考查,注意物质结构与性质的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间 | 开始 | 8h后 | 16h 后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直径介于1nm~100nm之间的微粒称为胶体 | |
| B. | 电泳现象可证明胶体带电 | |
| C. | 渗析法可用于含有氯化钠的淀粉溶液的提纯 | |
| D. | 用含1molFeCl3的溶液可制得6.02×1023个Fe(OH)3胶体粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>E>D | B. | A>B>D>E | C. | D>A>B>E | D. | D>E>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
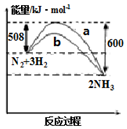
| A. | 该反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=92kJ•mol-1 | |
| B. | b曲线是升高温度时的能量变化曲线 | |
| C. | 加入催化剂,该化学反应的活化能和反应热都改变 | |
| D. | 在温度体积一定的条件下,通入lmol N2和3molH2 反应后放出的热量为Q1kJ,若通入2mol N2和6mol H2 反应后放出的热量为Q2kJ,则184>Q2>2Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、Fe2+、NO3-、SO42- | |
| B. | 水电离出的c(H+)=1×10-12mol•L-1的溶液中:K+、Al3+、Cl-、SO42- | |
| C. | 加入酚酞溶液显红色的溶液中:Na+、K+、HCO3-、Cl- | |
| D. | 无色溶液中:K+、NH4+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com