
| 高温 |
| C6(CO) |
| C2(N2) |
| C6(CO) |
| C2(N2) |
| 高温 |
| C6(CO) |
| C2(N2) |
| C6(CO) |
| C2(N2) |
| 1 |
| 3 |


科目:高中化学 来源: 题型:
 氮化硅是一种新型陶瓷材料,它可由石英晶体与焦炭颗粒在高温的氮气流中,通过如下反应制得:3SiO2+6C+2N2
氮化硅是一种新型陶瓷材料,它可由石英晶体与焦炭颗粒在高温的氮气流中,通过如下反应制得:3SiO2+6C+2N2 Si3N4+6CO,该反应过程中的能量变化如图所示;回答下列问题:
Si3N4+6CO,该反应过程中的能量变化如图所示;回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
氮化硅是一种新型陶瓷材料,它可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应:![]()
 该反应过程中的能量变化如图所示,回答下列问题。
该反应过程中的能量变化如图所示,回答下列问题。
(1)上述反应中的还原剂是__________________,其还原产物是______________________;
(2)请配平上述反应方程式,并把配平后的系数填在对应物质前的短线处;若反应中测得生成4.48LCO(标况下)气体,则转移的电子数为____________
(3)该反应是______________(填“吸热”或“放热”),反应热△H__________0(填 “>” “<”或 “=” )。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省洪湖市第二中学五校高一期中联考化学试卷(带解析) 题型:填空题
(12分)(一)、下列各项分别与哪个影响化学反应速率的因素的关系最为密切?
(1)硫在氧气中比在空气中燃烧剧烈
(2)MnO2加入双氧水中反应更剧烈
(3)同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完
(4)镁粉在冷水中反应仅有微量气泡逸出,但加热时则有大量气泡产生
(二)、氮化硅是一种新型陶瓷材料,它可由石英晶体与焦炭颗粒在高温的氮气流中,通过如下反应制得:3SiO2 + 6C + 2N2 Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题:
Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题:
(1)上述反应中的还原剂是 ,还原产物是 。
(2)若反应中测得生成4.48 L CO气体(标准状况下),则转移的电子数为 。
(3)该反应是 (填“吸热”或“放热”)反应。
(三)、在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示: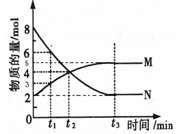
(1)写出该反应的化学方程式为 。
(2)比较t2时刻,正逆反应速率大小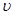 (正)
(正)  (逆)。(填“>”、“=”、“<”)。.
(逆)。(填“>”、“=”、“<”)。.
(3)若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为 。
(4)t3时刻化学反应达到平衡时反应物的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com