
��16�֣�������ҵ��ϴ�ֲ�ʱ�����ķ�Һ��Ҫ�ɷ�ΪFe2+��H+��Cl-�������������������÷�Һ������������Ʊ�������Ϳ�ϡ�
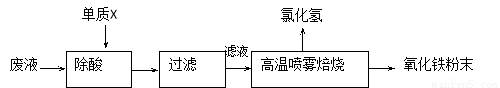
��1������X�Ļ�ѧʽ�� ��
��2���Ȼ�������Һ��������������ת��ΪHCl�������������ĩ���йصĻ�ѧ����ʽ����Ϊ�� ��
��3��ij����Ϳ���г�����Fe2O3�⣬������������CuO��FeO�е�һ��,�����ʵ�鷽����̽��������Ϳ����������ijɷ֡�
�� �����������
����1��������CuO
����2��������FeO
�� ����Ʒ�������֤�������裬д��ʵ�鲽�衢Ԥ������ͽ��ۡ�
��ѡ�Լ������ۡ�3mol?L-1H2SO4��0.1 mol?L-1����KMnO4��Һ��10%NaOH��Һ��10%H2O2��KSCN��Һ
�������� | Ԥ������ͽ��� |
����1��ȡ������Ʒ���Թ��У� ____________________________________________
|
��Ʒȫ���ܽ⣬�õ��������Һ�� |
����2��
����3��
|
___________________________
___________________________ |
��4������㣬��635gˮ��ȫ���ա������������ա�������HCl���� ������״���������ɵõ�36.5%��Ũ���ᣨ���ԭ������ Cl 35.5 H 1����
��16�֣���1�� Fe ��1�֣�д���Ʋ����֣�
��2��4FeCl2+ 4H2O+ O2  2Fe2O3 + 4HCl��3�֣�
2Fe2O3 + 4HCl��3�֣�
���� FeCl2+ 2H2O Fe(OH)2+ 2HCl��4Fe(OH)2+O2+2H2O = 4Fe(OH)3��
Fe(OH)2+ 2HCl��4Fe(OH)2+O2+2H2O = 4Fe(OH)3��
2Fe(OH)3 Fe2O3+ 3H2O��ÿʽ1�֣���3�֡�������������Ų���Ϊ�÷ֵ㣩
Fe2O3+ 3H2O��ÿʽ1�֣���3�֡�������������Ų���Ϊ�÷ֵ㣩
��3����10�֣�
�������� | Ԥ������ͽ��� |
����1��ȡ������Ʒ���Թ��У�����������3mol?L��1H2SO4���������2�֣� |
|
����2��ȡ����������Һ�ڣ������������ۣ�������ټ�������3mol?L��1H2SO4���������2�֣� ����3��ȡ��������1��Һ���Թ��У���μ���0.01 mol?L��1����KMnO4��Һ.��2�֣� ������2�Ͳ���3�IJ�����������ۿ��Ի���λ�ã� | ���Թ��г��ֺ�ɫ���壬˵����������CuO��2�֣� ����Ϻ�ɫ��ȥ��˵����������FeO��2�֣� |
��4�� 224 ��2�֣�
��������
�����������1���������̵�Ŀ�Ŀ�֪��X��Fe�����ᷴӦ�����������ӣ��ɳ�ȥ��ͬʱ�������������ʣ�
��2���Ȼ�������Һ��������������ת��ΪHCl�������������ĩ����֪�ù��̷�����������ԭ��Ӧ������Ӧ�������μӣ������൱�ڸ���ϵ���ȣ�������������Ӧ�����������ӵ�ˮ�⣬���������������������������������������������������������ֽ���������������Ըù������漰�Ļ�ѧ����ʽ�У�FeCl2+ 2H2O Fe(OH)2+ 2HCl��4Fe(OH)2+O2+2H2O = 4Fe(OH)3��2Fe(OH)3
Fe(OH)2+ 2HCl��4Fe(OH)2+O2+2H2O = 4Fe(OH)3��2Fe(OH)3 Fe2O3+ 3H2O��
Fe2O3+ 3H2O��
��3�����ݱ���������Ԥ������ͽ��ۣ�����1Ӧѡ���ᣬ��Ϊ������CuO����FeO���������ᣬ���Բ���1Ϊ������������3mol?L��1H2SO4���������ʱ��Һ�к���Cu2+��Fe2+ ��Fe3+������2��3��Ӧ�Ǽ�����Һ�е�Cu2+��Fe2+�����������Լ�������Cu2+��Ӧѡ�����ۡ�3mol?L-1H2SO4������Fe2+��Ӧ��0.1 mol?L-1����KMnO4��Һ�����岽������𰸣�
��4������635gˮ��ȫ���ա������������ա�������HCl����xmol�õ�36.5%��Ũ���ᣬ��36.5x/(635+36.5x)=36.5%�����x=10�����Կ����ձ�״���µ�HCl�������224L�ɵ�36.5%��Ũ���ᡣ
���㣺����Թ�ҵ���̵ķ�������㣬���ӵļ��飬ʵ�鷽�������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�Ͼ��и���9��ѧ����о���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йػ�ѧ�����ʾ��ȷ���ǣ���
A���������ױ��Ľṹ��ʽ��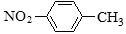 B��CH2F2�ĵ���ʽ��
B��CH2F2�ĵ���ʽ��
C��������Ϊ16����ԭ�ӣ�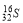 D����Ȳ�����ʽ��CH
D����Ȳ�����ʽ��CH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ�ع��и�����һ��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й����ʵ����ʺ����ʵ�Ӧ�þ���ȷ����
A�������������ԣ������ռ��ʯ���鷴Ӧ�Ʊ�����������
B��Ũ�������ǿ�����ԣ������¿�������ʢװ
C���������������ԣ�����������̲���
D���������ƾ���ǿ�����ԣ�������DZˮͧ����������Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ�����и�����ѧ�ڵ�һ����У�������ۻ�ѧ�Ծ��������棩 ���ͣ������
��16�֣��Ȼ����dz�����ˮ�����������÷���м���Ʊ���ˮ�Ȼ�����ʵ�����Ʊ��Ȼ�����װ������ͼ������֪������м�е����ʲ������ᷴӦ��
��1��ʵ���Ʊ������������£�
��.���ɼ� ���K1����K2�������رյ��ɼ� ���K1����K2������������a�������μ����ᡣ
��.�� ʱ���رյ��ɼ�K1�����ɼ�K2����A����Һ��ȫ�����ձ���رջ���a��
��.���ձ�����Һ���� ������õ�FeCl3��6H2O���塣
��.���FeCl3��6H2O�����Ƴ���ˮ�Ȼ�����
��2����������A�з���м�Ӵ������Ļ�ѧ��Ӧ����ʽ�ǣ� ��
��3��д��H2O2��Һ�з����ķ�Ӧ�����ӷ�Ӧ����ʽ�� ��
��4������Ʒ�����⣬���õ绯ѧ�����ķ�ʽ���Է�ֹ����Ʒ���⣬������ʯīΪ�����缫���ϣ��������Ʒ����ʾ��ͼ��������Ӧ��ע��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ�����и�����ѧ�ڵ�һ����У�������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ�����ӵ���������ֵ������˵����ȷ���ǣ��õ������ԭ��������H 1 O16 Al27��
A��18g 2H2O����10NA������
B��1mol������6NA��C��H��
C�����³�ѹ�£�22. 4L NH3Լ����NA��NH3����
D��27 g��ƬͶ������ŨH2SO4������1.5NA��SO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ�����и�����һ�ε��п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£�Na2CO3��Һ�д���ƽ�⣺CO32��+H2O HCO3��+OH���������йظ���Һ��˵����ȷ����
HCO3��+OH���������йظ���Һ��˵����ȷ����
A������Ũ�ȣ�c(Na+)>c(CO32��)>c(OH��)>c(H+) B�������¶ȣ�ƽ�������ƶ�
C������CaCl2Ũ��Һ����Һ��pH���� D������NaOH���壬��Һ��pH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ�����и�����ѧ�ڵ�һ��������⻯ѧ�Ծ��������棩 ���ͣ�ʵ����
������һ�ֻ���ԭ�ϡ�
��1����д����ҵ�Ϻϳɰ��Ļ�ѧ����ʽ��
��2��ʵ�����У��ס�����С��ѡ���˲�ͬ������ȡ�������뽫ʵ��װ�õ���ĸ��ź��Ʊ�ԭ����д���±��ո��С�
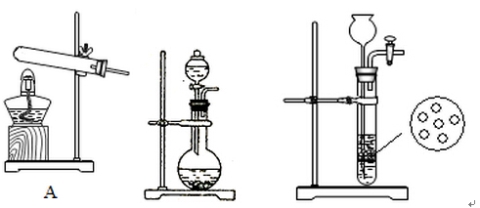
B C
| ʵ��װ�� | ʵ��ҩƷ | �Ʊ�ԭ�� |
���� | A
|
| ��Ӧ�Ļ�ѧ����ʽΪ �� |
���� |
| Ũ��ˮ���������ƹ��� | �������Ƶ����ã���ˮ�д���ƽ�⣺ |
��3�������һ��������ʵ�飬��֤NH3��H2O��������ʡ�
��
��4����ͬѧ���Ƶõİ�����������ˮ�У��õ�ϡ��ˮ���ñ�Ũ�ȵ�����ζ����ⶨ��Ũ�ȡ�ʵ�鲽�裺ȷ��ȡ10.00mLϡ��ˮ����ƿ�У�����20mLˮϡ�ͣ��μ� ��Һ��Ϊָʾ�����ʯ�������̪�����ȡ������� ���0.020������0.05������0.1980����1.5����mol?L-1����װ��50ml��ʽ�ζ��ܣ��ζ��� ��ֹͣ�ζ�����¼���ݡ��ظ��ζ�2�Ρ�ƽ����������Vml������ԭϡ��ˮ�����ʵ���Ũ��
= ��ֻ�г���ʽ���������㣩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ�����к���������8�����������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼ����±���
Ԫ�ش��� | X | Y | Z | M | N | R | Q | |
ԭ�Ӱ뾶(��10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 1.02 | 0.75 | 0.74 | |
��Ҫ���ϼ� | ������� | +1 | +7 | +3 | +2 | +6 | +5 | ���� |
����� | ���� | ��1 | ���� | ���� | ��2 | ��3 | ��2 | |
����˵����ȷ����
A����̬�⻯����ȶ��ԣ�N > Y
B��Ԫ��X��Q�γɵĻ������в����ܺ��й��ۼ�
C��M(OH)2�ļ��Ա�XOH�ļ���ǿ
D��X��Z��R������������Ӧ��ˮ����֮����������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�찲��ʡͬ����ʱ�����˽�ѡ��4��1.2 ȼ������Դ�Ծ��������棩 ���ͣ������
��֪�����Ȼ�ѧ����ʽ��
��CaCO3(s) CaO(s)+CO2(g)����H=+177��7 kJ
CaO(s)+CO2(g)����H=+177��7 kJ
��C(s)+H2O(g) CO(g)+H2(g)����H=+131��3 kJ��mol-1
CO(g)+H2(g)����H=+131��3 kJ��mol-1
��HCl(l)+NaOH(l) NaCl(l)+H2O(l)����H=-57��3 kJ��mol-1
NaCl(l)+H2O(l)����H=-57��3 kJ��mol-1
��C(s)+O2(g) CO2(g)����H=-393��5 kJ��mol-1
CO2(g)����H=-393��5 kJ��mol-1
��CO(g)+O2(g) CO2(g)����H=-283 kJ��mol-1
CO2(g)����H=-283 kJ��mol-1
��2H2(g)+O2(g) 2H2O(l)����H=-571��6 kJ��mol-1
2H2O(l)����H=-571��6 kJ��mol-1
��1�������Ȼ�ѧ����ʽ�У�����ȷ���С���
��2��������Ӧ�У���ʾȼ���ȵ��Ȼ�ѧ����ʽ�С���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com