
| A. | 1.2mol | B. | 1.6mol | C. | 0.4mol | D. | 0.2mol |
分析 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,3molCu作还原剂,有8mol硝酸参加反应,其中2molHNO3作氧化剂,以此来解答.
解答 解:38.4gCu的物质的量为:$\frac{38.4g}{64g/mol}$=0.6mol,根据反应3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O 可知,0.6mol铜完全反应消耗硝酸的物质的量为:0.6mol×$\frac{8}{3}$=1.6mol,其中作氧化剂被含有的硝酸的物质的量为:1.6mol×$\frac{2}{8}$=0.4mol,
故选C.
点评 本题考查了氧化还原反应的计算,题目难度不大,明确氧化剂、还原剂的能够及判断方法为解答关键,注意铜与稀硝酸的反应中只有部分硝酸被还原,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
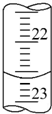 某学生用0.100 0mol•L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
某学生用0.100 0mol•L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 20.38 |
| 第二次 | 20.00 | 4.00 | 24.20 |
| 第三次 | 20.00 | 2.38 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
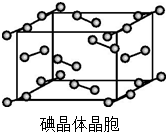 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解.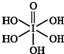 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”“<”或“=”).
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”“<”或“=”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═Na++H++CO32- | B. | H2SO4═2H++SO42- | ||
| C. | Ba(OH)2═Ba2++2OH- | D. | Al2(SO4)3═3SO42-+2Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
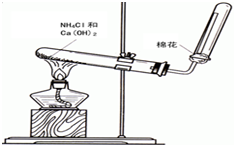 氨气是无色有刺激性恶臭的气味,极易溶于水的气体.如图是实验室制备氨气的装置图.
氨气是无色有刺激性恶臭的气味,极易溶于水的气体.如图是实验室制备氨气的装置图.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C中含有14个中子 | |
| B. | 1H、2H、3H是同一种核素 | |
| C. | H2O与D2O(重水)互称同位素 | |
| D. | C60、C70、金刚石、石墨均为碳的同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 或
或 (任写一种).
(任写一种). .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com