
| 反应时间/min | n(A)/mol | n(B)/mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | 0.20 |
| A. | 前10min内反应的平均速率为v(C)=0.050mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.50molA气体和0.60molB气体,到达平衡时,n(C)<0.25mol | |
| C. | 若密闭容器体积不变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动 | |
| D. | 温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应 |
分析 A.由表中数据可知,10min内A的物质的量变化量为1mol-0.5mol=0.5mol,由方程式可知C的物质的量变化量为0.5mol,根据v=$\frac{△c}{△t}$计算;
B.由表中数据可知,10min内A的浓度变化量为1mol-0.5mol=0.5mol,由方程式可知B的浓度变化量为2×0.5mol=1mol,10s时B浓度为0.2mol,10min时到达平衡,据此平衡时C的物质的量.
保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,等效为原平衡体积增大一倍,降低压强,A的转化率降低;
C.在达到平衡后持续缩小容器体积,压强增大物质可能液化;
D.计算温度T1℃时,该反应平衡常数,根据升高温度平衡常数的变化判断平衡移动方向.
解答 解:A.由表中数据可知,10min内A的浓度变化量为1mol-0.5mol=0.5mol,由方程式可知C的浓度变化量为0.5mol,故v(C)=$\frac{0.5mol÷2L}{10min}$=0.025 mol•L-1•min-1,故A错误;
B.由表中数据可知,10min内A的浓度变化量为1mol-0.5mol=0.5mol,由方程式可知B的浓度变化量为2×0.5mol=1mol,10s时B浓度为0.2mol,10min时到达平衡,由方程式可知C的浓度变化量为0.5mol.保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,等效为原平衡体积增大一倍,降低压强,A的转化率降低,故平衡时n(C)<0.25 mol,故B正确;
C.在达到平衡后持续缩小容器体积,压强增大,若B物质液化,平衡不移动,故C错误;
D.由表中数据可知,10min内A的物质的量变化量为1mol-0.5mol=0.5mol,A的浓度变化量为=0.25mol/L,则:
A(g)+2B(g)?C(g)
开始(mol/L):0.5 0.6 0
变化(mol/L):0.25 0.5 0.25
平衡(mol/L):0.25 0.1 0.25
故该温度下平衡常数k=$\frac{0.25}{0.25×0.{1}^{2}}$=100,降低为T2℃时,上述反应平衡常数为20,降低温度,平衡向逆反应进行,故正反应为吸热反应,故D错误;
故选B.
点评 本题考查反应速率计算、影响化学平衡因素、化学平衡常数等,难度中等,注意B选项可以根据平衡常数计算C的具体值,C选项为易错点、难点,对于增大压强气体液化,学生容易忽略.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液可保存在玻璃塞的试剂瓶中 | |
| B. | 一学生用pH试纸测得某氯水的pH为2 | |
| C. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| D. | 配制硫酸亚铁溶液,是将晶体溶于蒸馏水再加入一定量的铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1.0 MPa | 2.0 MPa | 3.0 MPa | |
| 800℃ | a | b | 83% |
| 900℃ | c | 75% | d |
| 1000℃ | 54% | e | f |
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取7.68gCuSO4加水配成480mL溶液 | |
| B. | 称取12.5g 胆矾,加水配成500mL溶液 | |
| C. | 称取8.0CuSO4,加水500mL 溶解配成溶液 | |
| D. | 称取12.0g胆矾,加水480mL溶解配成溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li2NH中N的化合价是-1 | |
| B. | 此法储氢和钢瓶储氢的原理相同 | |
| C. | 每有1molLi2NH参加反应,则有2mol电子转移 | |
| D. | 该反应中H2既是氧化剂,又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
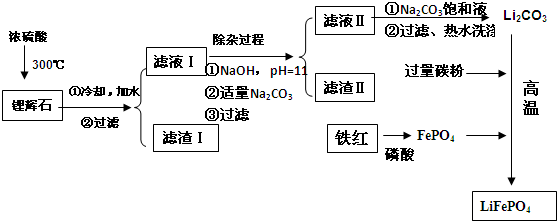
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
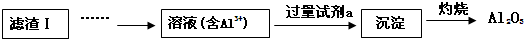
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23g钠在氧气中完全燃烧失去电子数为0.5NA | |
| B. | 1L 2 mol•L-1的AlCl3溶液中含Al3+数为2NA | |
| C. | 标准状况下,11.2L的SO3所含分子数为0.5NA | |
| D. | 室温下,8g甲烷含有共价键数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com