
在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是 。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是 。
(3)若三者c(H+)相同时,物质的量浓度由大到小的顺序是 。
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是 。
(5)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 ,反应所需时间的长短关系是 。
(6)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是 。
(1)b>a>c (2)b>a=c (3)c>a>b(或c>a=2b) (4)c>a=b (5)a=b=c a=b>c (6)c>a=b
解析试题分析:(1)氯化氢和硫酸是强电解质,在水中完全电离,盐酸是一元酸,所以盐酸中c(H+)=c(HCl),硫酸是二元酸,硫酸溶液中c(H+)=2c(H2SO4),醋酸是一元弱酸,所以醋酸溶液中c(H+)<c(CH3COOH),则当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是b>a>c;(2)同体积同物质的量浓度的三种酸,三种酸n(HCl)=n(CH3COOH)=n(H2SO4),盐酸和醋酸是一元酸,硫酸是二元酸,盐酸和醋酸需要氢氧化钠的物质的量相等,硫酸需要的氢氧化钠是盐酸和醋酸的2倍,中和NaOH能力由大到小的顺序是b>a=c;(3)氯化氢和硫酸是强电解质,盐酸是一元酸,硫酸是二元酸,醋酸是弱电解质且是一元酸,所以盐酸中氢离子浓度与酸的浓度相等,硫酸中氢离子浓度是硫酸的浓度的2倍,醋酸中氢离子浓度小于醋酸的浓度,所以当三者c(H+)相同时,物质的量浓度由大到小的顺序为c>a>b;(4)当三者c(H+)相同、体积相同时,盐酸、硫酸完全电离,只有醋酸在继续电离,则分别加入足量锌,相同状况产生的气体体积由大到小的顺序为c>a=b;(5)与锌反应时产生氢气的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,当c(H+)相同、体积相同时,同时加入形状、质量、密度相同的锌,则开始时反应速率的大小关系是a=b=c;反应过程中,醋酸不断电离,氢离子浓度较大,反应速率较快。反应所需时间的长短关系是a=b>c;(6)将c(H+)相同的三种酸均稀释相同倍数,盐酸、硫酸的变化相同,但醋酸为弱酸,促进电离,稀释相同的倍数时,其pH由大到小的顺序为a=b>c。
考点:考查强弱电解质的比较。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:单选题
对于常温下pH= 3的乙酸溶液,下列说法正确的是
| A.c(H+)=c(CH3COO-)+c(OH-) |
| B.加水稀释到原体积的10倍后溶液pH变为4 |
| C.加入少量乙酸钠固体,溶液pH降低 |
| D.与等体积pH=11的NaOH溶液混合后所得溶液中c(Na+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列溶液中有关物质的量浓度关系正确的是
A.NaHSO3溶液呈酸性,则有:c(Na+)>c(HSO3-)>c(SO32-) >c(H+)> c(OH-)
B.pH 相等的CH3COONa 和Na2CO3两种溶液:c(CH3COONa)<c(Na2CO3)
C.强酸HA溶液与弱碱MOH溶液混合后溶液呈中性,则有:c(M+)= c(A-)
D.0.1 mol·L-1的NaHA 溶液 pH=l:c(Na+)= c(H2A) + c(HA-) + c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(7分)请根据所学化学知识回答下列问题:
(1)在浓度均为0.1 mol/L ①CH3COONH4、②NH4HSO4、③NH3·H2O、④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为 (填序号)。
(2)氯化铝溶液蒸干,灼烧得到的固体物质是_________,用化学方程式说明其原因:
(3)某温度时蒸馏水的pH=6。将2.3 g金属钠放入该蒸馏水中,充分反应后再加该蒸馏水稀释到1 L,恢复到原温度时所得溶液的pH= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分)水的电离平衡曲线如图所示: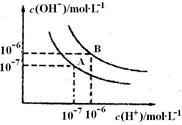
(1)A点表示25℃时水电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态变到B点,则100℃时水的离子积为_____________。
(2) 100℃时,若10体积的某强酸溶液与l体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pHa与强碱的pHb之间应满足的关系是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:
则NO2氧化SO2的热化学方程式为_________________________________。
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:2NH3(g) N2(g)+3H2(g),
N2(g)+3H2(g),
反应时间(t)与容器内气体总压强(p)的数据见下表
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强p 100 kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)钠及其化合物具有广泛的用途。
(1)工业上制备金属钠的常用方法是 (用离子方程式表示)。
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示:
正极的电极反应式为 ,电池工作时物质A可循环使用,A物质的化学式为 。
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
| 溶质 | CH3COONa | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
25℃时,某酸HA:Ka=1.0×10-7,已知:溶液的酸度AG=lg[c(H+)/c(OH-)]
(1)HA的电离方程式为 。
(2)0.1 mol·L-1HA溶液中,c(H+)= ,AG= 。
(3)保持25℃,下列方法能使HA溶液的电离度、溶液pH都增大的是 (填字母)
A.加水稀释 B.加少量盐NaA固体 C.加少量NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一学生在实验室测某溶液的pH,实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测:
(1)该学生的操作是 (填“正确的”或“错误的”),其理由是
(2)若用此方法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 ,原因是
(3)该学生以上述方式测定下列溶液的pH,无误差的是( )
| A.NaOH | B.CH3COONa | C.NaCl | D.NaHSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com