
【题目】氯及其氯的化合物,有广泛的应用。请回答下列问题:
(1)亚氯酸(HClO2)中氯元素的化合价是____,其电离方程式是______________,NaClO2溶液显_________(填“酸性”、“中性”、“碱性”)。
(2)①向新制饱和氯水中加适量CaCO3制取次氯酸,其反应的总的离子方程式是:_______。
②可用Cl2除去工业废水中CN- ,生成无污染的CO2和N2,写出反应的离子方程式:_____。
(3)CsICl2受热发生非氧化还原反应,则其受热分解的化学方程式是: ______________。
(4)ClO2是一种黄色极易爆炸的强氧化性气体,较安全的制备方法是:NaClO3+SO2+H2SO4—NaHSO4+ClO2(未配平),氧化剂与还原剂的物质的量之比是 _______。
(5)工业上高氯酸可由高氯酸钠和浓硫酸经复分解反应制备:NaClO4+H2SO4(浓)→NaHSO+HClO(易爆)。也可以用铜做阴极、铂做阳极,电解盐酸制备HClO4,写出阳极的电极反应式 ___________________________________________________ 。
【答案】 +3价 HClO2![]() H++ClO2- 碱性 CaCO3+2Cl2+H2O
H++ClO2- 碱性 CaCO3+2Cl2+H2O![]() Ca2++2Cl—+CO2↑+2HClO 2CN- + 5Cl2 + 4H2O
Ca2++2Cl—+CO2↑+2HClO 2CN- + 5Cl2 + 4H2O![]() 2CO2↑+ N2↑+ 10Cl- + 8H+ CsICl2
2CO2↑+ N2↑+ 10Cl- + 8H+ CsICl2![]() CsCl+ICl 2:1 Cl-+4H2O—8e-= ClO4-+8H+
CsCl+ICl 2:1 Cl-+4H2O—8e-= ClO4-+8H+
【解析】试题分析:本题考查氯及其化合物的性质,涉及电离方程式的书写,盐类的水解,化学方程式和离子方程式的书写,氧化还原反应的分析,电极反应式的书写。
(1)亚氯酸中H元素的化合价为+1价,O元素的化合价为-2价,根据正负化合价代数和为0,Cl元素的化合价为+3价。亚氯酸属于弱酸,电离方程式为HClO2![]() H++ClO2-。NaClO2属于强碱弱酸盐,其水溶液由于ClO2-的水解呈碱性。
H++ClO2-。NaClO2属于强碱弱酸盐,其水溶液由于ClO2-的水解呈碱性。
(2)①新制饱和氯水中存在反应:Cl2+H2O![]() HCl+HClO,加入适量CaCO3消耗HCl:CaCO3+2HCl=CaCl2+H2O+CO2↑,HCl浓度减小,Cl2与水的反应正向移动,制取HClO,将两反应相加消去HCl,得总反应的离子方程式为:2Cl2+CaCO3+H2O=Ca2++2Cl-+CO2↑+2HClO。
HCl+HClO,加入适量CaCO3消耗HCl:CaCO3+2HCl=CaCl2+H2O+CO2↑,HCl浓度减小,Cl2与水的反应正向移动,制取HClO,将两反应相加消去HCl,得总反应的离子方程式为:2Cl2+CaCO3+H2O=Ca2++2Cl-+CO2↑+2HClO。
②CN-转化成无污染的CO2和N2,分析化合价,C元素的化合价由+2价升至+4价,N元素的化合价由-3价升至0价,则Cl2被还原成Cl-,写出反应:Cl2+CN-→Cl-+CO2↑+N2↑,根据得失电子守恒配平:5Cl2+2CN-→10Cl-+2CO2↑+N2↑,结合原子守恒和电荷守恒,写出离子方程式为:5Cl2+2CN-+4H2O=10Cl-+2CO2↑+N2↑+8H+。
(3)Cl的非金属性强于I,在CsICl2中Cs、I、Cl的化合价依次为+1价、+1价、-1价,CsICl2受热发生非氧化还原反应,受热分解的化学方程式为CsICl2![]() CsCl+ICl。
CsCl+ICl。
(4)在反应中Cl元素的化合价由NaClO3中+5价降至ClO2中+4价,NaClO3为氧化剂;S元素的化合价由SO2中+4价升至NaHSO4中+6价,SO2为还原剂;根据得失电子守恒,n(NaClO3)![]() 1=n(SO2)
1=n(SO2)![]() 2,n(NaClO3):n(SO2)=2:1,氧化剂与还原剂物质的量之比为2:1。
2,n(NaClO3):n(SO2)=2:1,氧化剂与还原剂物质的量之比为2:1。
(5)根据题意,电解时阳极为惰性电极Pt,Cl-被氧化成ClO4-,阳极电极反应式为:Cl--8e-+4H2O=ClO4-


科目:高中化学 来源: 题型:
【题目】下列物质的沸点由高到低排列的顺序是 ( ) ①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3 ⑤(CH3CH2)2CHCl.
A.⑤②④①③
B.④②⑤①③
C.⑤④②①③
D.②④⑤③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了更好的解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻找新能源.以下做法不能提高燃料效率的是 ( )
A.煤的汽化与液化
B.液体燃料呈雾状喷出
C.通入大大过量的空气
D.将煤粉粉碎
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.同温同压下,相同体积的气体,其气体分子物质的量也相等
B.任何条件下,等物质的量的甲烷和一氧化碳所含的分子数可能不相等
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.同温同压下,若体积不相等,则一氧化碳气体和氮气质量可能相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类或性质与应用均正确的是( )
A. Al2O3的熔点很高,可用于制作耐高温材料
B. Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒
C. 硅晶体是良好的半导体,可用于制造光导纤维
D. Al(OH)3是一种强碱,可以与酸反应,可用作医用的胃酸中和剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g) + yB(g)![]() zC(g)平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断正确的是 ( )
zC(g)平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断正确的是 ( )
A. x + y < z B. 平衡向正反应方向移动
C. B的转化率降低 D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: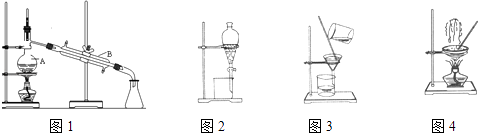
(1)装置图1中A的名称是 . A 中加入碎瓷片的作用是 .
(2)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: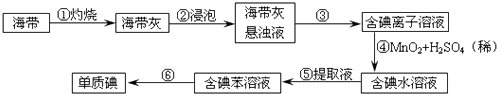
①灼烧海带时,除需要酒精灯与三脚架外,还需要用到的实验仪器是(从下列仪器中选出所需仪器,用标号字母填写在空白处);
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.铁架台 F.干燥器
②步骤③的实验选择上述装置图(填图的序号).步骤⑤的实验操作名称是 . 步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是 , 选择上述装置图(填图的序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物:①CH3CH3、②CH2=CH2、③CH3CH2C≡CH、④CH3C≡CCH3、⑤C2H6、⑥CH3CH=CH2中,一定互为同系物的是 , 一定互为同分异构体的是 . (填编号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com