
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
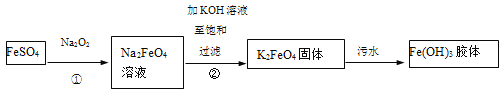
以下说法不正确的是
A.①中一定发生了氧化还原反应
B.污水处理中产生Fe(OH)3胶体,使悬浮物聚沉,利用了胶体具有较强吸附能力的特点
C.另一种在碱性条件下制备K2FeO4的反应可能是:2Fe(OH)3+3ClO-=2FeO42-+3Cl-+4H+ +H2O
D.K2FeO4还可以用于处理废水,例如可以把废水中的CN-转化为两种无毒气体,反应过程中,CN-做还原剂,被K2FeO4氧化
【答案】C
【解析】
硫酸亚铁溶液中加入过氧化钠发生氧化还原反应生成高铁酸钠溶液,向反应生成的高铁酸钠溶液加入足量氢氧化钾溶液至饱和,由于相同温度下,高铁酸钾的溶解度小于高铁酸钠,故转化为高铁酸钾沉淀,高铁酸钾在水中发生如下过程:4FeO42-+10H2O4Fe(OH)3(胶体)+8OH-+3O2↑,反应中高铁酸钾做氧化剂,具有杀菌消毒作用,生成的Fe(OH)3胶体具有吸附作用,可吸附水中的固体杂质,使悬浮物聚沉,从而起到杀菌消毒和吸附净化水的作用。
A.硫酸亚铁中加入过氧化钠反应后的产物为高铁酸钠,硫酸亚铁中铁为+2价,高铁酸钠中铁为+6价,铁元素化合价发生变化,则①中一定发生了氧化还原反应,故A正确;
B. 高铁酸钾在水中发生如下过程:4FeO42-+10H2O4Fe(OH)3(胶体)+8OH-+3O2↑,生成的Fe(OH)3胶体具有吸附作用,可吸附水中的固体杂质,使悬浮物聚沉,故B正确;
C. 氢离子与氢氧根离子不能共存,在碱性条件下制备K2FeO4的反应产物中不可能产生氢离子,正确的反应为:2Fe(OH)3+3ClO+4OH=2FeO42+3Cl+5H2O,故C错误;
D. K2FeO4还可以用于处理废水,可将可以把废水中的CN-转化为两种无毒气体,该两种无毒气体为二氧化碳和氮气,根据转化关系,氮元素和碳元素化合价都升高,故反应过程中,CN-做还原剂,高铁酸钾做氧化剂,故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO在工农业生产中有着重要的应用。
(1)CO是制备很多有机物(如甲醇、乙醇、甲醚等)的原料,现用CO与H2合成甲醇,反应如下:CO(g)+2H2(g)= CH3OH(g) △H=-99kJmol–1。
①已知断裂1molCO(g)中的化学键消耗的能量为1072kJ,断裂1molH2(g)中的化学键消耗的能量为436kJ,则形成1molCH3OH(g)中化学键释放的能量为_____。
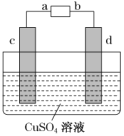
②用CH3OH 燃料电池电解精炼粗铜,装置如图所示。当消耗1mol甲醇时,d极质量增加了160g,则甲醇应加入____(填“a”或“b”)极,该电池的能量转化率为________(保留3位有效数字)。
(2)CO与Ni发生羰化反应形成的络合物可作为催化烯烃反应的催化剂。Ni的羰化反应为Ni(s)+4CO(g)![]() Ni(CO)4(g) △H<0,T0温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的
Ni(CO)4(g) △H<0,T0温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的![]() 倍。则:
倍。则:
①0~10min内平均反应速率v(Ni)=________gmin–1。
②研究表明正反应速率v正=k正x4(CO),逆反应速率v逆 =k逆x[Ni(CO)4](k正和k逆分别表示正反应和逆反应的速率常数,x为物质的量分数),则T0温度下,![]() =_____。
=_____。
③当温度升高时k正_______k逆(填“大于”“小于”或“等于”),此时CO的转化率___________(填“变大”“变小”或“不变”)。
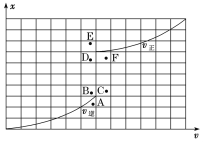
④T1温度下测得一定的实验数据,计算得到v正~x(CO)和v逆~x[Ni(CO)4]的关系可用如图进行表示。当降低温度时,反应重新达到平衡,相应的点分别为______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g)。
(1)在—定温度和压强下,CO(g)+2H2(g)![]() CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示)。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度________(填“增大”、“不变”或“减小”)。
CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示)。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度________(填“增大”、“不变”或“减小”)。
(2)判断该反应达到平衡状态的依据是________(填字母序号)。
a.混合气体的密度不变 b.混合气体的平均相对分子质量不变 c.2v逆(H2)=v正(CO) d.容器内CO、H2、CH3OH的浓度之比为1∶2∶1 e.CH3OH、CO、H2的浓度都不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.0080mol/L。
(1)求该反应的平衡常数______。
(2)在上述温度下,该容器中若通入H2和I2蒸气各0.20mol,试求达到化学平衡状态时各物质的浓度______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,三种酸的电离平衡常数如下表所示。
化学式 |
|
|
|
名称 | 醋酸 | 次氯酸 | 亚磷酸 |
电离平衡常数 |
|
|
|
回答下列问题:
(1)pH相等的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液中,物质的量浓度最小的是____________(填化学式)。
溶液中,物质的量浓度最小的是____________(填化学式)。
(2)已知![]() 为正盐,依据表格数据,
为正盐,依据表格数据,![]() 的第二级电离平衡常数表达式
的第二级电离平衡常数表达式![]() ___________;25℃时,5.6mol·L-1
___________;25℃时,5.6mol·L-1![]() 溶液的pH=____________。
溶液的pH=____________。
(3)向体积均为10mL、![]() 均为
均为![]() mol·L-1的
mol·L-1的![]() 溶液和一元酸
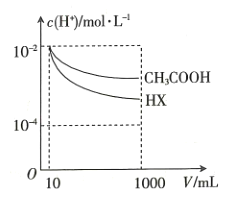
溶液和一元酸![]() 溶液中,分别加水稀释至1000mL,稀释过程中
溶液中,分别加水稀释至1000mL,稀释过程中![]() 的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)
的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)![]() 的电离平衡常数,理由是______________________________。
的电离平衡常数,理由是______________________________。
(4)常温下,将0.05mol·L-1的氨水逐滴加入10mL0.1mol·L-1![]() 溶液中至溶液显中性,此时溶液中各离子浓度大小关系为_________________。
溶液中至溶液显中性,此时溶液中各离子浓度大小关系为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。已知Ksp(AgCl)数量级为1010。下列叙述正确的是
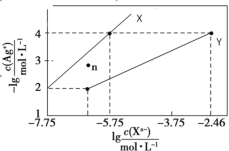
A.图中X线代表的Ag2C2O4
B.n点表示Ag2C2O4的过饱和溶液
C.向c(Cl)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成AgCl沉淀
D.Ag2C2O4+2Cl=2AgCl+ C2O42-的平衡常数为100.71
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol) P—P:198,P—O:360,O=O:498,则反应P4(白磷)+3O2![]() P4O6
P4O6
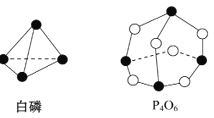
A. 放出1 638 kJ热量
B. 吸收1 638 kJ热量
C. 放出126 kJ热量
D. 吸收126 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科技工作者运用DFT计算研究HCOOH在不同催化剂(Pd和Rh)表面分解产生H2的部分反应历程如图所示,其中吸附在催化剂表面的物种用*表示。下列说法错误的是( )
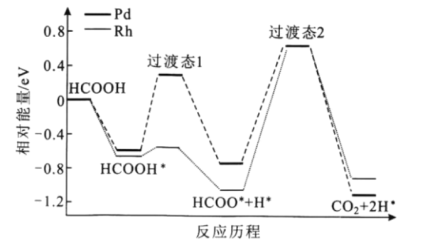
A.HCOOH吸附在催化剂表面是一个放热过程
B.Pd、Rh作催化剂时HCOOH分解产生H2的反应热不同
C.该反应过程中有C-H键的断裂,还有C=O键的生成
D.HCOO*+H*=CO2+2H*是该历程的决速步骤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com