
【题目】[化学——选修3:物质结构与性质]
H、C、N、O、Na、Fe、Cu是常见的七种元素,请回答下列问题:
(1)N、O、Na原子第一电离能由小到大的顺序是 (用元素符号和“<”表示);Cu原子的特征电子轨道式为 。
(2)N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是_____;Cu2+在水中呈现蓝色是因为形成了水合铜离子,其化学式为 ,水分子与铜离子间结合的化学键名称为 。
(3)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是_____(填序号):①H3O+、②H2O、 ③NO2+ 、④NO2- 。
(4)分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为 ,1个分子中含有____个![]() 键;(CN)2称为“拟卤素”,具有类似Cl2的化学性质,则(CN)2与NaOH水溶液反应的化学方程式为 。
键;(CN)2称为“拟卤素”,具有类似Cl2的化学性质,则(CN)2与NaOH水溶液反应的化学方程式为 。
(5)O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,该离子化合物的化学式为___________;已知该晶胞的密度为![]() ,阿伏加德罗常数为NA,求晶胞边长a=________cm。(用含
,阿伏加德罗常数为NA,求晶胞边长a=________cm。(用含![]() 、NA的代数式表示)。
、NA的代数式表示)。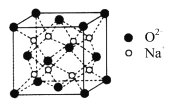
【答案】(1)Na<O<N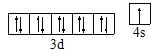 (2)Fe3+[Cu(H2O)4]2+配位键(3)② ④(4)
(2)Fe3+[Cu(H2O)4]2+配位键(3)② ④(4)![]() 4 (CN)2+2NaOH==NaCN+NaCNO+H2O(5)Na2O
4 (CN)2+2NaOH==NaCN+NaCNO+H2O(5)Na2O![]()
【解析】试题分析: (1)N、O属于非金属钠是金属,故钠的最小,N、O属于同周期,则N>O;核外电子,电子:[Ar]3d104s1,故特征电子轨道式为![]() 。
。
(2) 在N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中,未成对电子数依次是3、0、5、1,故未成对电子数最多的是Fe3+,Cu2+在水中呈现蓝色是因为形成了水合铜离子,其化学式为[Cu(H2O)4]2+,水分子与铜离子间结合的化学键名称为配位键。
(3)H3O+中中心原子O的价层电子对数为(6+3-1)/2=4,孤电子对数为1,所以空间构型是三角锥形;H2O中中心原子O的价层电子对数为(6+2)/2=4,孤电子对数为2,所以空间构型是V形;NO2+中中心原子N的价层电子对数为(5-1)/2=2,孤电子对数为0,所以空间构型是直线形;NO2-中中心原子N的价层电子对数为(5+1)/2=3,孤电子对数为1,所以空间构型是V形,故正确答案是② ④。
(4)分子(CN)2中碳原子按sp杂化,碳碳之间是单键,碳氮之间是参键,其结构式为N≡C-C≡N,碳氮参键中有两个π键,所以1个分子中含有4个π键;(CN)2与NaOH水溶液反应的化学方程式为(CN)2+2NaOH==NaCN+NaCNO+H2O。
(5)根据晶胞结构图,利用均摊法可知,晶胞中含有氧离子个数为8×1/8+6×1/2=4,含有钠离子个数为8,所以化学式为Na2O,根据ρ=m/v可知晶胞体积V=m/ρcm3=![]() ,cm3,故所以晶胞边长=
,cm3,故所以晶胞边长=![]() 。
。


科目:高中化学 来源: 题型:
【题目】室温下,用0.100 mol·L-1NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是
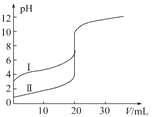
A.Ⅱ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗V(NaOH)小于20 mL
C.V(NaOH)=20.00 mL时,两份溶液中c(Cl-)=c(CH3COO-)
D.V(NaOH)=10.00 mL时,醋酸溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于官能团的判断中说法错误的是
A.醇的官能团是羟基(-OH)B.羧酸的官能团是羟基(-OH)
C.酚的官能团是羟基(-OH) D.烯烃的官能团是双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现钼酸钠可减缓金属的腐蚀速率。工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体( Na2MoO4·2H2O)的途径如图所示:
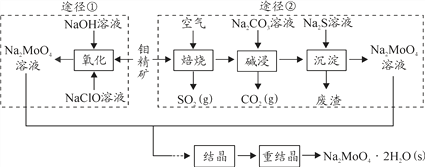
回答下列问题:
Ⅰ.(1)下列标志中,应贴在保存NaClO容器上的是 ___________。

(2)为了提高焙烧效率,除增大空气量外还可以采用的措施有_____________________。
(3)途径①制备钼酸钠溶液,同时有SO42-生成,该反应的离子方程式为_____________。
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是_________________________。
(5)“结晶”前测得部分离子浓度c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L,需加入Ba(OH)2固体除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率为______%。(保留三位有效数字)[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起溶液体积变化可忽略]。
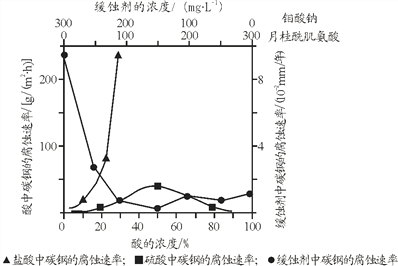
Ⅱ.(1)碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是_____。
(2)若缓释剂钼酸钠-月桂酰肌氨酸总浓度为300mgL-1,则缓蚀效果最好时钼酸钠的物质的量浓度为_________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质结构图中,●代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表除形成共价键外的其他最外层电子,短线代表共价键,如F2:![]() 。
。
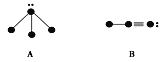

⑴试写出四种图示所代表的化学式:
A___________,B___________,C___________,D___________。
⑵将上述四种物质的液体呈细流流下,用带静电的玻璃棒靠近细流,细流发生偏转的是_____________(填“A”“B”“C”“D”)。
⑶B分子中有__________个δ键,___________个π键。
⑷C分子中,中心原子杂化类型____________其分子空间构型是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示的有机物X可生产S-诱抗素Y。下列说法正确的是
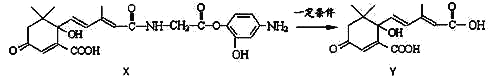
A. 1 mol Y最多能和6 molH2发生加成反应
B. X可以发生氧化、取代、加聚、酯化等反应
C. Y可以与FeCl3溶液发生显色反应,又可使酸性高锰酸钾溶液退色
D. X结构中有2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁可用于牙膏、医药和化妆品等工业,化学式为4MgCO3·Mg(OH)2·5H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下几个方案:
方案I取一定质量的样品,与硫酸充分反应,通过测定生成CO2的质量计算纯度
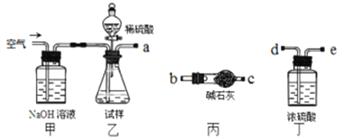
(1)乙中发生反应的方程式为____________。
(2)仪器接口的连接顺序为(装置可以重复使用)a___________,丁的作用是__________。
(3)当样品充分反应完后,缓慢通入空气的目的是:____________。
方案Ⅱ①称取碱式碳酸镁样品mg;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g/。
(4)下列仪器中,该方案不会用到的是____________。
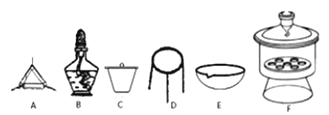
(5)判断样品完全分解的方法是_______;本实验至少需要称量_______次。
(6)有同学认为方案Ⅱ高温煅烧的过程中会发生MgCO3 +SiO2![]() MgSiO3 +CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______。(填“正确”或“错误”)请说明理由:____________。
MgSiO3 +CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______。(填“正确”或“错误”)请说明理由:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铁片和浓硫酸混合加热,充分应后得到溶液X,X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+,应选用
A. KSCN溶液和氯水
B. 铁粉和KSCN溶液
C. 浓氨水
D. 酸性KMnO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com