
【题目】已知:2M(g)![]() N(g);△H <0。现将M和N的混和气体通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间变化关系如右图所示。下列说法正确的是( )
N(g);△H <0。现将M和N的混和气体通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间变化关系如右图所示。下列说法正确的是( )
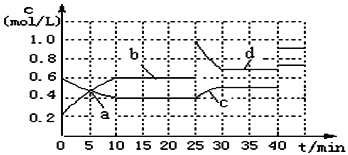
A.a、b、c、d四个点中处于平衡状态的点是a、b、d
B.反应进行至25min时,曲线发生变化的原因是加入了 0.4molN
C.若调节温度使35min时体系内N的百分含量与15min时相等,应升高温度
D.若40min后出现如图所示变化,则可能是加入了某种催化剂
【答案】C
【解析】
A. 根据图象可知在a、b、c、d四个点中处于平衡状态的点是物质的量浓度不变的状态,是b、d,A错误;
B. 由于反应物是M,生成物是N,在反应开始进行时不知道反应是正向进行还是逆向进行,所以至25min时,其中一种物质的浓度没变,而另一种物质的浓度突然增大,所以不能确定是反应物还是生成物增加,B错误;
C. 在35min时物质N平衡浓度大于15min时的,所以根据温度对化学平衡移动的影响,应该使平衡逆向移动,由于正反应是放热的,所以若调节温度使35min时体系内N的百分含量与15min时相等,应升高温度,C正确;
D. 若40min后出现如图所示变化,即物质的浓度增大,但是都不再发生变化,说明平衡没有发生移动,则不可能是加入了某种催化剂,D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾晶体![]() 可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。该小组同学查阅资料知,固体产物中铁元素不可能以三价形式存在,而盐只有
可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。该小组同学查阅资料知,固体产物中铁元素不可能以三价形式存在,而盐只有![]() ,产生的气体中含有CO、
,产生的气体中含有CO、![]() 。
。
请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:①蒸馏水②![]() 溶液③氧化铜④
溶液③氧化铜④![]()
![]() 盐酸⑤浓硫酸⑥
盐酸⑤浓硫酸⑥![]()
![]() 溶液⑦澄清石灰水⑧
溶液⑦澄清石灰水⑧![]()
![]()
![]() 溶液 ⑨
溶液 ⑨![]() 溶液⑩苯酚溶液
溶液⑩苯酚溶液
(1)若用一套连续实验装置检验气体产物中CO的存在,并验证检验过程中有![]() 生成,应选用的试剂为
生成,应选用的试剂为![]() 按先后顺序把所选试剂的标号填入空格内
按先后顺序把所选试剂的标号填入空格内![]() ______。
______。
(2)提出合理假设
假设1:只有Fe;假设2:只有FeO;假设3: ______ 。
(3)设计实验方案并实验验证
步骤1:取适量固体产物于试管中,加入足量蒸馏水溶解,过滤分离出不溶固体。
步骤2:取少量上述不溶固体放入试管中,加入足量 ______ 溶液,充分振荡。若固体无明显变化,则假设 ______ 成立;若有暗红色固体生成,则反应的离子方程式为 ______ 。
步骤3:取步骤2所得暗红色固体于试管中,滴加过量 ______ ,振荡后静置。若溶液基本无色,则假设 ______ 成立;若溶液呈 ______ ,则假设3成立。
(4)问题讨论
若固体产物中FeO含量较少,用步骤3方法难以确定。请你设计实验方案证明假设3成立![]() 写出实验的操作步骤、现象与结论
写出实验的操作步骤、现象与结论![]() : ______。
: ______。
(5)拓展与延伸
有资料介绍“在含![]() 的溶液中,先滴加少量新制饱和氯水,然后滴加KSCN溶液,溶液呈红色;若再滴加过量氯水,却发现红色褪去”。假设溶液中的
的溶液中,先滴加少量新制饱和氯水,然后滴加KSCN溶液,溶液呈红色;若再滴加过量氯水,却发现红色褪去”。假设溶液中的![]() 价铁还能被氯水氧化为更高价的
价铁还能被氯水氧化为更高价的![]() ,试写出该反应的离子方程式 ______。
,试写出该反应的离子方程式 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:

请你帮助该同学整理并完成实验报告:
(1)实验目的:_______________。
(2)实验用品:
仪器:________________;药品:__________。
(3)实验内容:(填写题给信息表中的序号)_____
实验方案 | 实验现象 | 有关化学方程式 |
_____ | _____ | _____ |
_____ | _____ | _____ |
_____ | _____ | _____ |
_____ | _____ | _____ |
_____ | _____ | _____ |
_____ | _____ | _____ |
(4)实验结论:____________。
(5)请用物质结构理论简单说明具有上述结论的原因。__________
(6)请你补充两组简单易行的实验方案,证明此周期中另外两种元素的性质递变规律。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中因双水解而不能大量共存的是
A.能使甲基橙变红的溶液中:K+、Mg2+、NO3-、I-
B.c(HCO3-)=1 mol·L-1溶液中:Na+、NH4+、SO42-、OH-
C.澄清透明溶液中: Fe3+、Al3+、NO3-、CO32-
D.![]() =1012的溶液中:Na+、Ba2+、Cl-、AlO2-
=1012的溶液中:Na+、Ba2+、Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水电离平衡如图所示,且pOH=-lg c(OH-)。下列说法错误的是
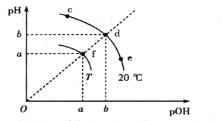
A.各点对应的水的离子积:Kw(f)>Kw(e)=Kw(d)
B.加热f点纯水,其组成由f点沿fd直线向d方向迁移
C.向c点溶液中通入少量HCl,其组成由c点沿cde曲线向e点移动
D.df直线上各点对应的水溶液(或纯水)一定显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料。
(1)工业上可利用CO生产乙醇:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)=== H2O(g) ΔH2
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(2)一定条件下,H2、CO在体积固定的绝热密闭容器中发生如下反应:
4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g),
下列选项能判断该反应达到平衡状态的依据的有_____________。
A.v(H2)= 2 v(CO)
B.平衡常数K不再随时间而变化
C.混合气体的密度保持不变
D.混合气体的平均相对分子质量不随时间而变化
(3)工业可采用CO与H2反应合成再生能源甲醇,反应:
CO(g)+ 2H2(g)![]() CH3OH(g)
CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如下图所示。
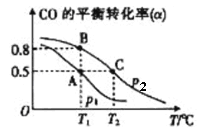
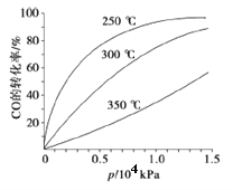
①合成甲醇的反应为___________(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为___________。P1和P2的大小关系为___________。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为______L。
④CO的平衡转化率(α)与温度(T)、压强(p)的关系如下图所示,实际生产时条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式:
①![]() ; ②
; ②![]() ;
;
③![]() ; ④
; ④![]() 。
。
则下列有关比较中正确的是
A. 电负性:④>③>②>① B. 原子半径:④>③>②>①
C. 第一电离能:④>③>②>① D. 最高正化合价:④>③=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2的燃烧热为285.8 kJ/mol,CO的燃烧热为282.8 kJ/mol。现有H2和CO组成的混合气体56.0 L(标准状况下),经充分燃烧后,一共放出热量710.0 kJ,并生成液态水。下列说法正确的是( )
A. CO燃烧的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=+282.8 kJ/mol
B. H2燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ/mol
C. 燃烧前的混合气体中,H2的体积分数为40%
D. 混合气体燃烧后与足量的过氧化钠反应,电子转移总数为2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠![]() 是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,
是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,![]() ,以木炭、浓硝酸、
,以木炭、浓硝酸、![]() 为主要原料制备亚硝酸钠的装置如图所示
为主要原料制备亚硝酸钠的装置如图所示![]() 部分夹持装置已略去
部分夹持装置已略去![]() 。下列说法正确的是( )
。下列说法正确的是( )
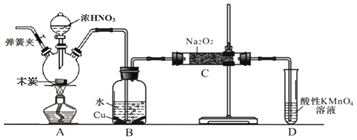
A.可以将B中药品换成NaOH溶液
B.应在B、C之间加一个盛放无水![]() 的干燥管
的干燥管
C.实验开始前先向装置中通入![]() ,实验结束时先停止通入
,实验结束时先停止通入![]() 再熄灭酒精灯
再熄灭酒精灯
D.装置D可用于尾气处理,标况下每吸收![]() L的尾气消耗
L的尾气消耗![]() mol高锰酸钾
mol高锰酸钾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com