
【题目】图1是铜锌原电池示意图,图2中,x轴表示实验时流入正极的电子的物质的量, 下列说法中不正确的是
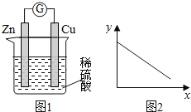
A.y轴可表示锌片的质量
B.y轴可表示溶液中c(H+)
C.若导线上转移2mol电子,则有2molH2生成
D.溶液中的阳离子向正极移动,阴离子向负极移动
【答案】C
【解析】
锌-铜-硫酸构成的原电池中,根据原电池原理,锌片作负极,随着反应的进行,锌单质失去电子生成锌离子进入溶液,锌片的质量会不断减轻;铜作正极,硫酸溶液中的氢离子在铜电极上放电生成氢气,溶液中的氢离子浓度会减小;溶液中阳离子移向正极,阴离子移向负极。
A.由图像,结合分析可知,随着反应的进行,电路中转移的电子数增多,锌片会不断溶解,质量减轻,故A正确;
B.由分析可知,溶液中氢离子浓度随着转移的电子数增多而减小,故B正确;
C.根据化合价变化,每生成1mol氢气,电路中转移的电子数为2mol,则若导线上转移2mol电子,则有1molH2生成,故C错误;
D.原电池装置中,溶液中阳离子移向正极,阴离子移向负极,故D正确;
综上所述,答案为C。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】通过测定混合气中O2含量可计算已变质的Na2O2 (含Na2CO3) 纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是
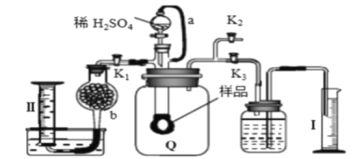
A. 干燥管b中装入碱石灰
B. Q气球中产生的气体主要成份O2、CO2
C. 测定气体总体积必须关闭K1、K2,打开K3
D. 读完气体总体积后,关闭K3,缓缓打开K1;可观察到Q气球慢慢缩小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯产量是衡量一个国家石油化工水平的主要标志。下图是由乙烯合成乙酸乙酯可能的合成路线:
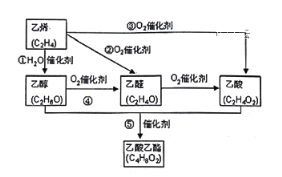
请回答下列问题:
(1)反应④的化学方程式为_____________________________ ;
(2)在实验室制备乙酸乙酯时,用到饱和的碳酸钠溶液,其作用是:___________________;
(3)乙醇的结构式为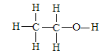 ,若实验证明乙醇分子有一个特殊氢原子的反应的化学方程式为 _________________________________;
,若实验证明乙醇分子有一个特殊氢原子的反应的化学方程式为 _________________________________;
(4)乙酸乙酯的同分异构体(只含一种官能团)有______________种;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界水产养殖协会网介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。下列说法正确的是
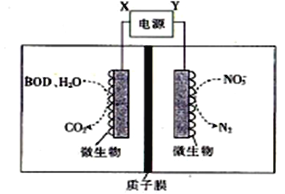
A. X为电源负极
B. 若该装置在高温下进行,则净化效率将降低
C. 若有1molNO3-被还原,则有6molH+通过质子膜迁移至阴极区
D. 若BOD为葡萄糖(C6H12O6),则1mol葡萄糖被完全氧化时,理论上电极流出20 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是

A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡增大c(Cu2+),c(Cl—)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl—(aq)
Cu2+(aq)+Cl—(aq)![]() CuCl(s)的ΔH=(a+2b) kJ·mol-1
CuCl(s)的ΔH=(a+2b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。

请回答下列问题:
(1)操作①应包括下列操作中的____________。(填序号)
A.溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
(2)用氨水调节pH至8~9的目的是_________________________________。
(3)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+____(填“是”或“不”)沉淀完全。[已知c(Ca2+)≤10-5 mol/L时即可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中c(NH4+) _______c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出该反应的化学方程式_________________________;用简要的文字解释用氢氧化钠调节pH至9~11的原因____________。
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3 转化为CaO2过程中,Ca原子的利用率__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,使用一对石墨电极电解饱和Na2SO4溶液,当转移2 mol电子时停止电解,析出Na2SO4·10H2O晶体m g,所有数据都在相同温度下测得,下列叙述不正确的是
A. 电解后溶液质量减少(m+18)g
B. 原溶液中Na2SO4的质量分数为![]()
C. 若其他条件不变,将石墨替换为铜电极,则阴极析出1mol H2
D. 若其他条件不变,将石墨替换为铜电极,则析出Na2SO4·10H2O晶体仍为m g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量Cl2,溶液中某些离子的物质的量变化如下图所示。下列说法中,不正确的是
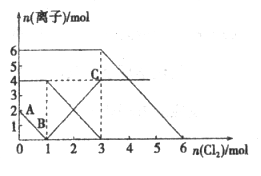
A. 还原性:I->Fe2+>Br-
B. 原混合溶液中FeBr2的物质的量为6 mol
C. 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
D. 当通入2mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是
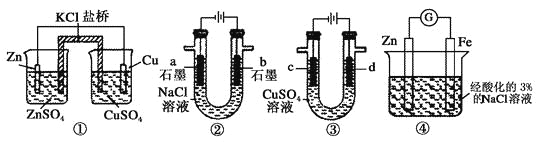
A. 装置①中,盐桥中的Cl-移向ZnSO4溶液
B. 装置②工作一段时间后,b极附近溶液的pH增大
C. 用装置③精炼铜时,c极为粗铜
D. 装置④中电子由Zn流向Fe,装置中有Fe2+生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com