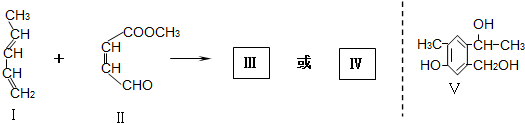
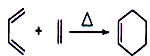解答:
解:(1)基态Ti
2+价电子排布式为:3d
2,最高能层为M层,该能层下含有1个3s轨道、3个3p轨道和5个3d轨道,共有9个原子轨道,
故答案为:M;9;
(2)a.NH
3分子中N原子含有3个共用电子对和一个孤电子对,所以其价层电子对是4,采用sp
3杂化,故a错误;
b.等电子体为原子数相等和价电子数相等的原子团,NH
+4与PH
+4、CH
4、BH
-4均含有5个原子团,且价电子均为8,为等电子体,而ClO
-4价电子数为32,不属于等电子体,故b错误;
c.分子间存在氢键的熔沸点高,相同压强时,氨气中含有氢键,PH
3中不含氢键,所以NH
3沸点比PH
3高,故c正确;
d.提供孤电子对的原子是配原子,[Cu(NH
3)
4]
2+离子中,N原子提供孤对电子,N原子为配原子,故d正确;
故答案为:cd;
(3)根据配合物结构判断,Cu
2+提供空轨道,NH
3和NF
3中中心原子N原子提供孤电子对,由于N、F、H三种元素的电负性为F>N>H,在NF
3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难于与Cu
2+形成配位键,
故答案为:N、F、H三种元素的电负性为F>N>H,在NF
3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难于与Cu
2+形成配位键;
(4)SnBr
2分子中Sn原子价层电子对个数=2+
×(4-2×1)=3,所以Sn原子的轨道杂化方式为SP
2杂化,且含有一个孤电子对,所以该分子为V形分子,孤电子对对成键电子对有排斥作用,所以其键角小于120°,
故答案为:SP
2杂化;<;
(5)与NaCl晶胞类型一致,其配位数也为6;该晶胞的边长为a nm,则晶胞体积=a
3 ×10
-21cm
3,根据均摊法可知,在NiO晶胞中含镍原子数为8×
+6×
=4,氧原子数为1+12×
=4,NiO的摩尔质量为b g?mol
-1,所以晶胞的质量为
,所以晶胞的密度ρ=
=
=
g?cm
-3,
故答案为:6;
;



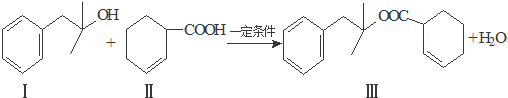
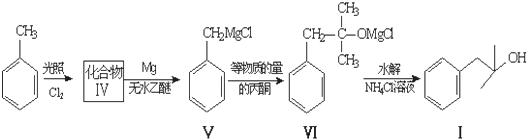
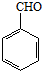 也能发生类似V→I的反应,请写出生成醇的结构简式
也能发生类似V→I的反应,请写出生成醇的结构简式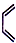 ;
;