
【题目】化学与生活、社会密切相关。下列说法正确的是( )
A.Si常用做信息高速公路的骨架—光导纤维的主要材料
B.近年来已发布“空气质量日报”,将CO2、NO2和可吸入颗粒物等列入了首要污染物
C.煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料
D.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
科目:高中化学 来源: 题型:
【题目】压强变化不会使下列化学反应的平衡发生移动的是 ( )
A. H2(气)+I2(气) ![]() 2HI(气)
2HI(气)
B. 3H2(气)+N2(气) ![]() 2NH3(气)
2NH3(气)
C. 2SO2(气)+O2(气) ![]() 2SO3(气)
2SO3(气)
D. C(固)+CO2(气) ![]() 2CO(气)
2CO(气)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示“O2的氧化性随溶液pH的增大逐渐减弱”。某兴趣小组探究不同条件下KI与O2的反应.实验如下。
装置 | 烧杯中的液体 | 现象(5分钟后) |
| ①2 mL1 mol/LKI溶液+5滴淀粉 | 无明显变化 |
②2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L HCl | 溶液变蓝 | |
③2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L KCl | 无明显变化 | |
④2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
(1)实验②中生成I2的离子方程式是___________。
(2)实验③的目的是_________________________________________________________________。
(3)实验④比②溶液颜色浅的原因是________。
(4)为进一步探究KI与O2的反应,用上表中的装置继续进行实验:
烧杯中的液体 | 现象(5小时后) |
⑤2 mLpH=8.5混有KOH的1mol/L KI溶液+5滴淀粉 | 溶液才略变蓝 |
⑥2 mLpH=10混有KOH的1mol/L KI溶液+5滴淀粉 | 无明显变化 |
I.对于实验⑥的现象.甲同学提出猜想“pH=10时O2不能氧化I-”,设计了下列装置进行实验,验证猜想。

i.烧杯a中的溶液为____。
ii.实验结果表明,此猜想不成立。支持该结论的实验现象是:通入O2后,_______。
Ⅱ.乙同学向pH=10的KOH溶液(含淀粉)中滴加碘水,溶液先变蓝后迅速褪色.经检测褪色后的溶液中含有IO3-,褪色的原因是(用离子方程式表示)____________。
(5)该小组同学对实验过程进行了整体反思.推测实验①的现象产生的原因可能是______;实验⑥的现象产生的原因可能是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种回收并利用含碘(I-)废液的工艺流程如下:

(1)“沉淀”中生成CuI的离子方程式为___________________。
(2)CuSO4的投加量对废水中I-的去除量影响较大,不同投加量(用过量系数表示)下,反应后I-和Cu2+的浓度如图所示,则适宜的CuSO4过量系数应为_____,分析原因___________。

(3)反应Ⅰ中生成铁与碘的化合物(其中铁与碘的质量比为21:127),则加入的水的作用是__________,反应Ⅱ的化学方程式是_____________________________。
(4)操作Ⅰ包括______,冰水洗涤的目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将标准状况下体积为2.24L的H2S缓慢通入100ml,1.5mol/L NaOH溶液中(溶液体积变化忽略不计),充分反应后,下列关系不正确的是( )
A. c(Na+)+c(H+)=c(HS-)+2 c(S2-)+c(OH-) B. 2c(Na+)=3[c(HS-)+c(S2-)+c(H2S)]
C. c(Na+)>c(HS-)>c(S2-)>c(H+)>c(OH-) D. c(HS-)+c(S2-)+c(H2S)=1.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保证青少年和儿童的健康成长,每天饮用的水应含有一定量的钙、镁等离子。目前市售的“蒸馏水”“纯净水”因不含有钙、镁离子,不宜长期、大量饮用。为保证青少年儿童的健康成长,这些饮料水应添加一些化学物质。这些微量添加物应该是( )
A.精盐
B.石灰石粉
C.可溶的钙和镁的碳酸氢盐
D.胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年全国各地都遭受“十面霾伏”。其中机动车尾气和燃煤产生的烟气对空气质量恶化“贡献”最大。汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g) +N2(g) ΔH <0。在t℃下,将2.0molNO、2.4molCO气体通入到容积固定的2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
2CO2(g) +N2(g) ΔH <0。在t℃下,将2.0molNO、2.4molCO气体通入到容积固定的2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:

(1)该反应平衡常数的表达式为________。
(2)20min时,c(CO2)为__________,NO的转化率为__________。
(3)0--10min的平均速率v(N2)=__________。
(4)20min时,若改变反应条件,导致CO转化率增大,则改变的条件可能为__(填序号)。
A.缩小容器容积 B.增加CO的量
C.降低温度 D.使用催化剂
(5)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行t1时刻达到平衡状态的是_______(填代号)【下图中的v(正)、K、n、w分别代表正反应速率、平衡常数、物质的量、质量分数】

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用硝酸为原料生产亚硝酸钠的工艺流程如下,等物质的量的NO和NO2恰好能被Na2CO3溶液在吸收塔中完全吸收生成NaNO2 . 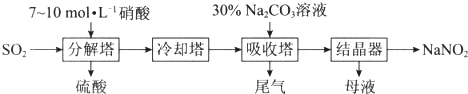
(1)吸收塔中发生反应的化学方程式是 .
(2)分解塔中需要严格控制硝酸的浓度,目的是 .
(3)向母液中加入硝酸,发生反应3NaNO2+2HNO3=3NaNO3+2NO↑+H2O,经结晶可制得副产品NaNO3 . 对该过程中产生的NO的处理方法是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com