
将 和
和 以体积比1∶3混合后,于500℃条件下通过催化剂,发生如下反应:
以体积比1∶3混合后,于500℃条件下通过催化剂,发生如下反应:

 达平衡时,在同温、同压下测得反应前与反应后混合气的密度比为71∶80,求
达平衡时,在同温、同压下测得反应前与反应后混合气的密度比为71∶80,求 的转化率?又知工业上反应前后的上述密度比稍小于71∶80,试回答接触法制硫酸时不采取加压措施的主要原因.
的转化率?又知工业上反应前后的上述密度比稍小于71∶80,试回答接触法制硫酸时不采取加压措施的主要原因.
|
(1) (2)工业上 |
|
方法一:设起始时  为1体积, 为1体积, 为3体积. 为3体积.
设达平衡时  转化的体积为x 转化的体积为x
反应前气体的平均相对分子质量为 (64×1+32×3)/4=40反应后气体的平均相对分子质量为 
根据反应前后气体密度之比为 71/80解之得 x=0.9
工业上反应前与平衡时混合气的密度比稍小于71∶80,即工业上 方法二:相同条件下气体的密度之比等于同体积气体的质量之比,现此反应前后质量守恒,即反应前后质量相同,所以气体的密度之比等于气体体积之反比.
解之,得 x=0.9. |


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

 Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解 Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解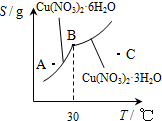
 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,Cu与液态N2O4反应制得无水硝酸铜的化学方程式是
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,Cu与液态N2O4反应制得无水硝酸铜的化学方程式是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| Cu |
| △ |
| Cu |
| △ |
| Cu |
| △ |
| Cu |
| △ |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(NH3) | n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
计算下列溶液的PH ,并将计算结果填在空格上:
(1)c(H+) = 1×10-4 mol/L的溶液 ;
(2)c(OH-) = 1×10-4 mol/L的溶液 ;
(3)将0.1 mol HCl溶于水制成100 ml溶液 ;
(4)将PH=2的HCl溶液和PH=2的H2SO4溶液以体积比3:1混和
(5)将0.23g金属钠溶于水并配制成100 mL的溶液 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com