
| H | + 4 |
A、C
| ||
B、N
| ||
| C、SCN- | ||
D、S
|


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
| A、100g质量分数为98%的硫酸溶液中含氧原子数为4NA |
| B、200mL、0.5mol/L的Na2CO3溶液中,由于CO32-水解,所以阴离子数目小于0.1NA |
| C、精炼铜时,当阳极质量减少6.4g时,电路中转移电子数不一定为0.2NA |
| D、相同体积的O2和O3含有相同的分子个数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将串联一小灯泡的该酸溶液与串联一相同小灯泡的硫酸并联,接通电源后,若该溶液上的灯泡较暗,则说明该酸是弱酸 |
| B、测定该酸的钠盐溶液常温下的pH,若pH>7,则说明该酸是弱酸 |
| C、用该酸的溶液与金属锌反应,产生气泡较慢,则说明该酸是弱酸 |
| D、中和等体积等浓度的NaOH溶液消耗该酸的量大于硫酸,则说明该酸是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高压 |
| 450℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1溴化钠溶液:K+、H+、Cl-、SO42- | ||
| B、由水电离的c(H+)=10-10 mol?L-1的溶液:Na+、Fe2+、NO3-、AlO2- | ||
| C、使酚酞试液变红的溶液:NH4+、Al3+、CO32-、CH3COO- | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用甲图装置比较NaHCO3和Na2CO3的热稳定性 |
| B、用乙图装置制备Fe(OH)2 |
| C、用丙图装置制备并收集少量NO2气体 |
| D、用丁图装置制取少量金属锰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
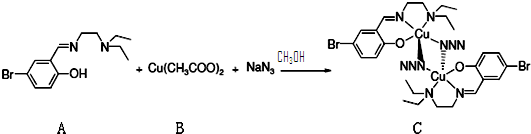
| ||
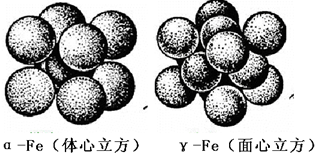
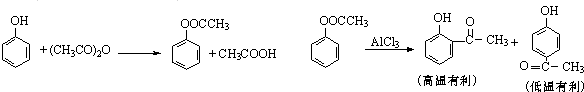
| 反应温度/℃ | 反应时间(min) | 收率 |
| 30~35 | 180 | 10.0 |
| 20~25 | 60 | 18.0 |
| 20~25 | 120 | 26.0 |
| 20~25 | 180 | 58.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com