
(1)将等径圆球在二维空间里进行排列,可形成密置层和非密置层。在图1所示的半径相等的圆球的排列中,A属于________层,配位数是________;B属于________层,配位数是________。
(2)将非密置层一层一层地在三维空间里堆积,得到如图2所示的一种金属晶体的晶胞,它被称为简单立方堆积,在这种晶体中,金属原子的配位数是______,平均每个晶胞所占有的原子数目是__________。
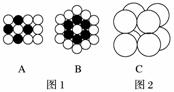
(3)有资料表明,只有钋的晶体中的原子具有如图2所示的堆积方式。钋位于元素周期表的第__________周期第________族,元素符号是________,最外层电子排布式是________________________________________。
科目:高中化学 来源: 题型:
某兴趣小组在实验室用铜和硫酸为原料,采用多种方法制取硫酸铜,制备方法如下:
方法一
(1)浓硫酸试剂瓶上适合贴上的标签是________(填序号)。

(2)甲同学取6.4 g铜片和10 mL 18 mol·L-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀。甲同学为了验证其中灰白色沉淀的主要成分,设计下列实验:
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌。
实验现象:_________________________________。
实验结论:所得灰白色固体的化学式为__________。
(3)乙还观察到加热过程中,试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸而消失。淡黄色固体消失的原因是(用化学方程式回答)________________________________________________________________________。
直到最后反应完毕,发现试管中还有铜片剩余,乙根据自己所学的化学知识,认为试管中还有硫酸剩余。他这样认为的理由是________________________________________________________________________。
方法二
(4)丙同学认为甲设计的实验方案不好,他自己设计的思路是2Cu+O2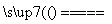 2CuO,CuO+H2SO4===CuSO4+H2O。
2CuO,CuO+H2SO4===CuSO4+H2O。
对比甲的方案,你认为丙同学的优点是①________________________________________________________________________;
②________________________________________________________________________。
方法三
(5)丁同学取一铜片和稀硫酸放在试管中,再向其中滴入双氧水发现溶液逐渐呈蓝色,写出反应的化学方程式________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子的外围电子排布式为 。
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 。
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。如①CH2=CH2、②HC≡CH、③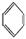 、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为
、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为
形。
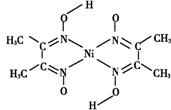
(4)丁二酮肟常用于检验Ni2+。在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如右图所示。该结构中,除共价键外还存在配位键,请在图中用箭头表示出配位键。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有几组物质的熔点(℃)数据:
| A组 | B组 | C组 | D组 |
| 金刚石:3 550 ℃ | Li:181 ℃ | HF:-83 ℃ | NaCl:801 ℃ |
| 硅晶体:1 410 ℃ | Na:98 ℃ | HCl:-115 ℃ | KCl:776 ℃ |
| 硼晶体:2 300 ℃ | K:64 ℃ | HBr:-89 ℃ | RbCl:718 ℃ |
| 二氧化硅:1 723 ℃ | Rb:39 ℃ | HI:-51 ℃ | CsCl:645 ℃ |
据此回答下列问题:
(1)A组属于________晶体,其熔化时克服的微粒间的作用力是________。
(2)B组晶体共同的物理性质是________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于_________________________________________。
(4)D组晶体可能具有的性质是__________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。
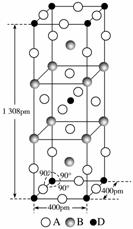
①该化合物的化学式为________;D的配位数为__________;
②列式计算该晶体的密度__________g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有______________;该化合物中存在一个复杂离子,该离子的化学式为__________,配位体是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)。
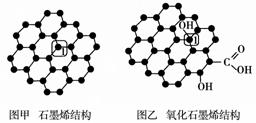
(1)图甲中,1号C与相邻C形成σ键的个数为________。
(2)图乙中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图甲中1号C与相邻C形成的键角。
(3)若将图乙所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
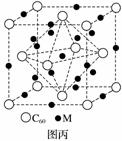
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,在a g HmX中所含质子的物质的量是 ( )
A.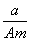 (A-N+m)mol B.
(A-N+m)mol B.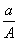 (A-N)mol
(A-N)mol
C.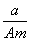 (A-N)mol D.
(A-N)mol D.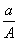 (A-N+m)mol
(A-N+m)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于常见有机物的说法正确的是( )
A.乙炔的化学性质与乙烯的相似,也能形成高分子化合物
B.甲烷是水煤气的主要成分
C.不粘锅的原料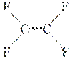 为烃类化合物
为烃类化合物
D.葡萄糖、鸡蛋清均能与NaOH溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com