
 ,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.
,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO. 分析 (1)根据含氮化合物对环境的影响来回答,氮氧化物是污染性气体,容易形成光化学烟雾;
(2)氨气具有还原性,NO2具有强氧化性,二氧化氮氧化氨气生成氮气和水;
(3)氨气与氯化氢气体混合反应生成白色固体氯化铵,反应现象冒白烟,依据此现象可以检验氨气或氯化氢是否泄漏;
(4)若将少量氨气与过量氯气混合,则生成一种酸和另一种化合物A,A中所有原子均满足8电子稳定结构,生成的酸是HClO,A为NCl3,三氯化氮和水反应生成次氯酸和氨气.
解答 解:(1)氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,故答案为:产生光化学烟雾或形成酸雨;
(2)氨气具有还原性,NO2具有强氧化性,二氧化氮氧化氨气生成氮气和水,反应的化学方程式为:8NH3+6NO2=7N2+12H2O,
故答案为:8NH3+6NO2=7N2+12H2O;
(3)氨气与氯化氢气体混合反应生成白色固体氯化铵,NH3+HCl=NH4Cl,反应现象产生白烟,依据此现象可以检验氨气或氯化氢是否泄漏,
故答案为:产生白烟,检验氨气或氯化氢是否泄漏;
(4)若将少量氨气与过量氯气混合,则生成一种酸和另一种化合物A,A中所有原子均满足8电子稳定结构,生成的酸是HClO,A为NCl3,电子式为 ,三氯化氮和水反应生成次氯酸和氨气,反应方程式为NCl3+3H2O=NH3+3HClO,
,三氯化氮和水反应生成次氯酸和氨气,反应方程式为NCl3+3H2O=NH3+3HClO,
故答案为: ;NCl3+3H2O=NH3+3HClO.
;NCl3+3H2O=NH3+3HClO.
点评 本题考查氨气和氯气性质,侧重考查学生分析推断能力,知道氨气的检验方法及现象,掌握物质性质是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
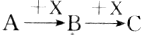 已知A、B、C三种物质有如图所示的转化关系(反应可在溶液中进行),其中A与C在一定条件下也能发生反应,则A不可能是( )
已知A、B、C三种物质有如图所示的转化关系(反应可在溶液中进行),其中A与C在一定条件下也能发生反应,则A不可能是( )| A. | SiO2 | B. | CH3CH2OH | C. | AlCl3 | D. | Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 离子方程式 | |
| A | 向淀粉KI溶液中滴加硫酸氢钠溶液 | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2═2I2+2H2O |
| B | 将氯水滴加到含KSCN溶液的绿矾溶液中 | 溶液由浅绿色变为红色 | 2Fe2++Cl2═2Fe3++2Cl-, Fe3++3SCN-═Fe(SCN)3 |
| C | 向硫化钠和亚硫酸钠的混合液中滴加稀盐酸 | 产生淡黄色沉淀 | 2S2-+SO32-+6H+═3S↓+3H2O |
| D | 向含酚酞的氢氧化钡溶液中滴加稀硫酸 | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业制粗硅 | B. | 湿法炼铜 | ||
| C. | 用稀盐酸与石灰石反应制取CO2 | D. | 稀硫酸与锌粒反应制取氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4L | B. | 8L | C. | 10L | D. | 12L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com