
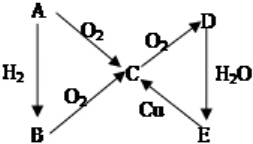
 (有些反应条件均已省略,如加热、点燃等)则A的化学式可能是( )
(有些反应条件均已省略,如加热、点燃等)则A的化学式可能是( )| A. | N2 | B. | Cl2 | C. | S | D. | C |
分析 根据题中各物质的转化关系,若A为N2,则A与氢气反应生成B为NH3,A与氧气反应生成C为NO,C与氧气生成D为NO2,D与水反应生成E为HNO3,E与铜反应生成C,符合各物质的转化关系,若A为Cl2,则A与氢气反应生成B为HCl,A与氧气不反应,则不符合各物质的转化关系,若A为S,则A与氢气反应生成B为H2S,A与氧气反应生成C为SO2,C与氧气生成D为SO3,D与水反应生成E为H2SO4,E与铜反应生成C,符合各物质的转化关系,若A为C,则A经过两步氧化再与水反应生成E为碳酸,碳酸不能与铜反应生成CO,据此答题.
解答 解:根据题中各物质的转化关系,若A为N2,则A与氢气反应生成B为NH3,A与氧气反应生成C为NO,C与氧气生成D为NO2,D与水反应生成E为HNO3,E与铜反应生成C,符合各物质的转化关系,故A正确;若A为Cl2,则A与氢气反应生成B为HCl,A与氧气不反应,则不符合各物质的转化关系,故B错误;若A为S,则A与氢气反应生成B为H2S,A与氧气反应生成C为SO2,C与氧气生成D为SO3,D与水反应生成E为H2SO4,E与铜反应生成C,符合各物质的转化关系,故C正确;若A为C,则A经过两步氧化再与水反应生成E为碳酸,碳酸不能与铜反应生成CO,所以不符合各物质的转化关系,故D错误,故选AC.
点评 本题主要考查了无机物的推断,涉及氮、硫、氯、碳等几种常见非金属元素及其化合物的相互转化,中等难度,答题时注意熟记常见元素化合物知识,侧重对基础知识的考查.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 moL•L-1 | B. | 1.0 moL•L-1 | C. | 1.2 moL•L-1 | D. | 1.5 moL•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | HA | HNO2 | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2a-4b}{V}$ | B. | $\frac{2(a-b)}{V}$ | C. | $\frac{a-2b}{V}$ | D. | $\frac{2a-b}{V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溶解后过滤的方法除去CaCl2中的少量的ZnSO4 | |
| B. | 用萃取的方法分离NaCl溶液和汽油 | |
| C. | 用酒精萃取碘水中的碘 | |
| D. | 用蒸馏的方法除去水中的不挥发的杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
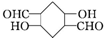 )
)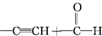 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$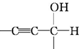
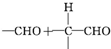 $\stackrel{稀NaOH}{→}$
$\stackrel{稀NaOH}{→}$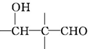
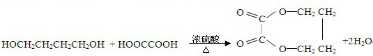 (注明条件).
(注明条件).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com