
硫代硫酸钠是一种常见的化工原料。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2。
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_________________。
(2)用该方法获得的Na2S2O3·H2O晶体中常混有一定量的杂质。某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水)。
【提出假设】 假设1:晶体中只含Na2CO3杂质
假设2:晶体中只含Na2S杂质
假设3:________________________________________________________________________。
【查阅资料】 Na2S2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O。
【判断与思考】 某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立。你认为其结论是否合理?________(填“合理”或“不合理”)并说明理由:_________________________________________。
【设计方案进行实验】 基于假设1,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂:3 mol·L-1H2SO4、1 mol·L-1NaOH、酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
| 实验方案 | 现象及结论 |
(3)已知:2Na2S2O3+I2===2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010 mol·L-1的碘水进行多次取样滴定,测得Na2S2O3·5H2O的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是________________________________。
科目:高中化学 来源: 题型:
已知:①为纪念著名天文学家哥白尼,国际纯粹与应用化学联合会将112号元素的符号定为“Cn”,汉语名为“ ”;②合理利用核能符合“低碳经济”的要求,
”;②合理利用核能符合“低碳经济”的要求, 92U是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β锂辉矿(主要成分是LiAlSi2O6,还含有FeO、MgO、CaO等杂质)。下列有关叙述对上述所涉及元素的说法正确的是( )
92U是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β锂辉矿(主要成分是LiAlSi2O6,还含有FeO、MgO、CaO等杂质)。下列有关叙述对上述所涉及元素的说法正确的是( )
A. Cn的原子核内中子数与核外电子数之差为55
Cn的原子核内中子数与核外电子数之差为55
B. 92U和
92U和 92U是同位素,核反应属于化学变化
92U是同位素,核反应属于化学变化
C.40Ca2+与18O 具有相同的电子数
具有相同的电子数
D.Si2O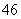 中质子总数为80
中质子总数为80
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.甲苯和乙烯均可使酸性KMnO4溶液褪色
B.纤维素、淀粉和蛋白质都是高分子化合物
C.煤的干馏和石油的分馏均属化学变化
D.酯类和糖类均能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
通过化学反应原理猜测可能生成哪些物质,对这些物质逐一进行检验来确定究竟含有哪些物质。正确解答此类试题的关键:(1)猜测要全面;(2)熟记常见物质的检验方法。
| [典例] | 审题指导 |
| 某研究性学习小组用下列装置(铁架台等夹持仪器略)探究氧化铁与乙醇的反应,并检验反应产物。 | 联想:乙醇的催化氧化。 |
| (1)用2%的CuSO4溶液和10%的NaOH溶液配制Cu(OH)2悬浊液的注意事项是________________________________________________________________________。 | 新制Cu(OH)2悬浊液与醛基的反应需要碱性条件。 |
| (2)为快速得到乙醇气体,可采用的方法是________________________________________________________________________。 若实验时小试管中的溶液已经开始发生倒吸,可采取的措施是________(填字母)。 a.取下小试管 b.移去酒精 c.将导管从乳胶管中取下 d.以上都可以 | ①升高温度可加速乙醇的挥发。 ②若液体倒吸入加热的反应管,可能会造成反应管炸裂,取下小试管已无济于事,因“溶 液已经开始发生倒吸”。 |
| (3)如图实验,观察到红色的Fe2O3全部变为黑色固体M,充分反应后停止加热。取下小试 管,加热,有砖红色沉淀生成。 为了检验M的组成,进行下列实验。 ①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成; ②经检验溶液中有铁离子和亚铁离子,检验铁离子的方法是_____________________;证明溶液含有亚铁离子的方法是________________________________________________________________________。 能得出的结论是________(填字母)。 a.M中一定有+3价和+2价铁,不能确定是否有0价铁 b.M中一定有+3价和0价铁,无+2价铁 c.M中一定有+3价铁,0价和+2价铁至少有一种 d.M中一定有+3价、+2价和0价铁 | 破题关键 分析黑色固体(M)可能的成分,铁的氧化物Fe3O4、FeO和铁粉均为黑色,Fe3O4中既有+3价铁又有+2价铁,且具有磁性,Fe3+能溶 解单质铁。 易错警示 已知溶液中有Fe3+,检验Fe2+不能用KSCN 溶液。 |
| (4)若M的成分可表达为FexOy,用CO还原法定量测定其化学组成。称取m g M样品进行定量测定,实验装置和步骤如下:
①组装仪器;②点燃酒精灯;③加入试剂;④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧…… 正确的操作顺序是________(填字母)。 a.①⑤④③②⑥⑦⑧ b.①⑤③④②⑥⑦⑧ c.①③⑤④②⑦⑥⑧ d.①③⑤②④⑥⑦⑧ 若M完全被还原后碱石灰增重n g,则 | 破题关键 Ⅰ.检查气密性属于实验的准备阶段,应在加药品前进行。 Ⅱ.类比氢气还原氧化铜。 Ⅲ.碱石灰增加的质量即为反应产生的CO2的质量,得关系式M中n(O)=n(CO2)。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知亚硫酸钠在空气中能被氧气氧化生成硫酸盐。
Ⅰ.甲同学设计两种方案来检验Na2SO3溶液是否发生变质。
方案一:取样,加入稀盐酸有气泡生成,认为亚硫酸钠溶液没有变质。
方案二:取样,加入氯化钡溶液有白色沉淀生成,认为亚硫酸钠溶液完全变质。
请你对两方案作出评价:
方案一:________(填“合理”或“不合理”),理由是_______________________
________________________________________________________________________。
方案二:________(填“合理”或“不合理”),理由是____________________________
________________________________________________________________________。
Ⅱ.乙同学探究Na2SO3溶液是否发生变质,设计如下实验测定1.0 mol·L-1 Na2SO3溶液的实际浓度。

(1)分液漏斗中应加入足量的下列哪种试剂?________(填字母)
a.浓硝酸 b.65%硫酸 c.浓盐酸
(2)实验前后测得C装置增重3.2 g,则Na2SO3溶液实际的物质的量浓度为________。
(3)该实验装置还存在一个明显的缺陷是________。
答案 Ⅰ.不合理 亚硫酸钠部分变质时滴加盐酸也会产生气泡 不合理 亚硫酸钠也能与氯化钡反应生成白色沉淀,亚硫酸钠未变质或部分变质时也会产生白色沉淀
Ⅱ.(1)b (2)0.83 mol·L-1
(3)缺少一个驱赶残留二氧化硫气体的装置(或其他合理答案)
查看答案和解析>>
科目:高中化学 来源: 题型:
分析下图所示的四个原电池装置,其中结论正确的是( )
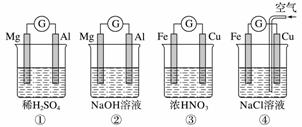
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+
D.④中Cu作正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
请运用原电池原理设计实验,验证Cu2+、Fe3+氧化性的强弱。请写出电极反应式,负极________________________________________________________________________,
正极________________________________________________________________________,
并在方框内画出实验装置图,要求用烧杯和盐桥,并标出外电路电子流向。
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是( )
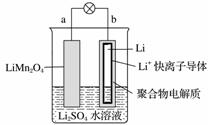
A.a为电池的正极
B.电池充电反应为LiMn2O4===Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时BaSO4饱和溶液中存在BaSO4(s)Ba2+(aq)+SO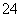 (aq),Ksp=1.102 5×10-10,向c(SO
(aq),Ksp=1.102 5×10-10,向c(SO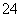 )为1.05×10-5 mol·L-1的BaSO4溶液中加入BaSO4固体,SO
)为1.05×10-5 mol·L-1的BaSO4溶液中加入BaSO4固体,SO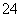 的浓度怎样变化?试通过计算说明。
的浓度怎样变化?试通过计算说明。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com