
| A. | NaCl | B. | KCl | C. | CaCl2 | D. | AlCl3 |
分析 假设氯化镁中不含杂质,根据关系式:MgCl2~2AgCl,则95 mg可生成AgCl 287mg,现生成AgCl 300mg,说明杂质是含氯量大于MgCl2中含氯量的物质,分别计算各选项中Cl的含量与氯化镁比较即可得出答案.
解答 解:若考虑极限情况,即氯化镁中不含杂质,
根据关系式:MgCl2~2AgCl,
95 287
95mg 287mg
则95mg可生成AgCl 287mg,现生成AgCl 300mg,说明杂质是含氯量大于MgCl2中含氯量的物质,氯化镁中Cl的含量为$\frac{35.5×2}{24+35.5×2}$=0.747,
A.氯化钠中Cl的含量为$\frac{35.5}{23+35.5}$=0.607,小于氯化镁中Cl的含量,故A错误;
B.氯化钾中Cl的含量为$\frac{35.5}{39+35.5}$=0.477,小于氯化镁中Cl的含量,故B错误;
C.氯化钙中Cl的含量为$\frac{35.5×2}{40+35.5×2}$=0.640,小于氯化镁中Cl的含量,故C错误;
D.氯化铝中Cl的含量为$\frac{35.5×3}{27+35.5×3}$=0.798,大于氯化镁中Cl的含量,故D正确;
故选D.
点评 本题考查混合物的计算,题目难度不大,注意用极限假设法解题.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:解答题
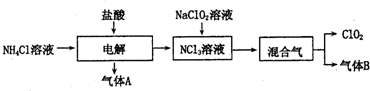
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下可用铁制容器来盛装浓硫酸、说明常温下铁与浓硫酸不反应 | |
| B. | 同一元素的各种同位素的物理性质不同、化学性质相同 | |
| C. | 金属元素的原子只有还原性,离子只有氧化性 | |
| D. | 取碘水于试管中,加入汽油振荡后静置,其现象为下层呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
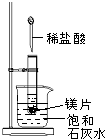 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16.5克过氧化钾晶体中,含0.3NA个阴离子 | |
| B. | 1mol铜粉与硫粉充分反应可转移2mol电子 | |
| C. | 含等物质的量溶质的NaHSO4溶液和Na2SO4 溶液中,均含2NA个阳离子 | |
| D. | 20 g NH3T+中含有中子数为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为三角锥形 | |
| C. | BF3是三角锥形分子 | |
| D. | SiF4和SO32-的中心原子均为sp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
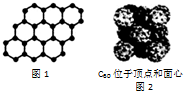
| A. | SiO2晶体中最小环上的原子数为6 | |
| B. | 在晶体中只要有阳离子就一定有阴离子 | |
| C. | 12g石墨烯(如图1)中含有六元环的个数为0.5NA | |
| D. | 720g C60晶体(如图2)中含有0.5NA个晶胞结构单元 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量相等密度不等的N2和C2H4 | B. | 等体积等密度的CO和C2H4 | ||
| C. | 等温、等压,等体积的O2和N2 | D. | 常温常压下,等质量的NO和CO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com