
科目:高中化学 来源: 题型:
某温度下,在密闭容器中SO2、O2、SO3三种气态物质建立化学平衡后,改变条件对反应[2SO2(g)+O2(g)  2SO3(g),ΔH<0]的正、逆反应速率的影响如图所示:
2SO3(g),ΔH<0]的正、逆反应速率的影响如图所示:
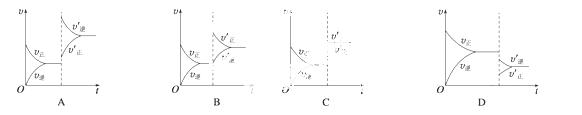
(1)加催化剂对反应速率影响的图像是________(填序号,下同),平衡________移动。
(2)升高温度对反应速率影响的图像是________,平衡向________方向移动。
(3)增大反应容器体积对反应速率影响的图像是________,平衡向________方向移动。
(4)增大O2的浓度对反应速率影响的图像是__________,平衡向________方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的操作过程,正确的是 ( )
A.钠与水的反应:用镊子从试剂瓶中取出金属钠,用小刀切下绿豆粒大小的一粒钠,小心放入装满水的烧杯中
B.配制100 mL的质量分数10%的H2O2溶液:取一支规格为100 mL的量筒,先取质量分数为30%的双 氧水溶液33.3 mL,然后加水至100 mL刻度线
氧水溶液33.3 mL,然后加水至100 mL刻度线
C.检验 某浅绿色溶液中含有Fe2+:取该溶液少许,向其中加入KSCN溶液,不变血红色;再向其中滴加氯水,溶液变为血红色
某浅绿色溶液中含有Fe2+:取该溶液少许,向其中加入KSCN溶液,不变血红色;再向其中滴加氯水,溶液变为血红色
D.取出分液漏斗中所需的上层液体:当下层液体从分液漏斗下端管口流出后,及时关闭活塞,然后更换一个接收容器,打开活塞 将分液漏斗中的液体放出
将分液漏斗中的液体放出
查看答案和解析>>
科目:高中化学 来源: 题型:
化学实验室中常对溶液或试剂进行酸化,下列酸化处理中正确的是
A.定性检验C2H5Cl中的氯元素时,将C2H5Cl和NaOH溶液混合加热,加稀硫酸酸化,再用硝酸银溶
液检验
B.鉴别溶液中SO42-和CO32-时,所加的氯化钡溶液可以用盐酸酸化
C.为提高 高锰酸钾溶液的氧化能力,用浓盐酸将高锰酸钾溶液酸化
高锰酸钾溶液的氧化能力,用浓盐酸将高锰酸钾溶液酸化
D.实验室在配置Fe2(SO4)3溶液时,通常滴加几滴稀硫酸酸化
查看答案和解析>>
科目:高中化学 来源: 题型:
某地甲、乙两厂排放的污水中各含有下列8种离子中的4种(两厂废水所含离子不同 ):Ag+、Ba2+、
Fe2+、Na+、Cl-、SO42-、NO3-、OH-。若两厂单独排放污水都会造成严重的水污染,如将两厂的污水按一
定比例混合,沉淀后污水便能变得无色澄清,溶质主要含硝酸钠,污染程度大大降低。根据所给信息有以
下几种说法,你认为正确的是
A.Na+和NO3-来自同一工厂 B.Cl-和NO3-一定来自同一工厂
C.Ag+和Na+可能来自同一工厂 D.SO42-和OH-一定来自同一工厂
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物X,它的氧化产物甲和还原产物乙都能和金属钠反应放出H2。甲和乙反应可生成丙,甲和丙均能发生银镜反应。这种有机物X是
A.甲醇 B.甲醛 C.甲酸 D.甲酸甲酯
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A的分子式为C9H12 ,它不能因反应而使溴水褪色,但能使酸性KMnO4溶液褪色,苯环上的一溴代物有3种,符合此条件的烃的结构有( )
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组同学为探究Fe3+能否氧化SO2,设计了如下的实验装置(假设实验中所用装置的气密性良好)。
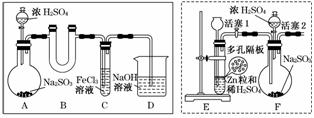
(1)甲同学利用实线框内的装置制取SO2,并进行探究实验。
①装置A中发生反应的化学方程式为_________________________________________。
②装置B的作用是________________________________________________________。
③反应一段时间后,甲同学取出装置C中的少量溶液,向其中加入盐酸酸化的BaCl2溶液,观察到有白色沉淀生成。由此得出结论:Fe3+可以氧化SO2。
(2)乙同学认为甲同学的实验不严谨,用虚线框内的装置代替装置A,先让装置E内的试剂反应一段时间后,关闭活塞1,打开活塞2,又反应片刻后,取装置C中的少量溶液,向其中加入酸性KMnO4溶液,观察到KMnO4溶液紫红色褪去。由此得出结论:Fe3+可氧化SO2,且可被SO2还原成Fe2+。
①该实验制取H2时需用浓硫酸配制450 mL 3 mol·L-1的稀硫酸,所需的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需用到______________________________________。
配制过程中若其他操作无误,但没有洗涤烧杯与玻璃棒,则所配制溶液的浓度会___ _____(填“偏高”、“偏低”或“无影响”)。
②在该实验过程中,H2所起的作用是________________________________________。
(3)丙同学认为甲、乙两位同学的实验均不严谨,为此利用乙同学的实验装置及操作重新进行实验。待装置F内的试剂反应一段时间后,取装置C中的少量溶液,向其中加入盐酸酸化的BaCl2溶液,得出与甲同学相同的结论。
①甲同学实验不严谨的原因是________(填序号)。
A.SO2的溶解度太小
B.SO2与Fe3+不发生反应
C.H2SO3与BaCl2溶液不反应
D.装置中的空气与SO2进入水中可生成H2SO4
②乙同学的实验结论不严谨的原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2===2K2CO3+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2 L(标准状况)CO2和KO2反应后,气体体积变为18.8 L(标准状况),计算反应消耗的KO2的质量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com