
【题目】常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是
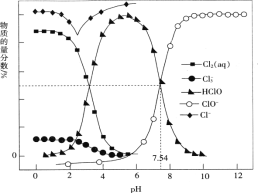
A. 氯水中的Cl2、ClO-、HClO均能与KI发生反应
B. 常温下反应Cl2(aq)+Cl-(aq)![]()
![]() (aq)的K=0.191,当pH增大时,K减小
(aq)的K=0.191,当pH增大时,K减小
C. pH=1的氯水中,c(Cl2)>c(![]() )>c(HClO)>c(ClO-)
)>c(HClO)>c(ClO-)
D. 该温度下,HClO![]() H++ClO-的电离常数Ka的对值lgKa=-7.54
H++ClO-的电离常数Ka的对值lgKa=-7.54
【答案】B
【解析】
A、氯水中的Cl2、ClO-、HClO均具有强氧化性;
B、平衡常数只与温度有关,温度不变,当pH增大时,K不变;
C、根据图象可知,pH=1时,c(Cl3-)>c(HClO)由溶液电荷守恒可得c(H+)>c(Cl3-),c(Cl2)最大;
D、HClO![]() H++ClO-的电离常数k=
H++ClO-的电离常数k=![]() ,pH=7.54时,c(ClO-)=c(HClO),k=c(H+)=10-7.54。
,pH=7.54时,c(ClO-)=c(HClO),k=c(H+)=10-7.54。
A、氯水中的Cl2、ClO-、HClO均具有强氧化性,均能将碘离子氧化,故A正确;
B、平衡常数只与温度有关,温度不变,当pH增大时,K不变,故B错误;
C、根据图象可知,pH=1时,c(Cl3-)>c(HClO)由溶液电荷守恒可得c(H+)>c(Cl3-),c(Cl2)最大,pH=1的氯水中,c(Cl2)>c(![]() )>c(HClO)>c(ClO-),故C正确;
)>c(HClO)>c(ClO-),故C正确;
D、HClO![]() H++ClO-的电离常数k=
H++ClO-的电离常数k=![]() ,pH=7.54时,c(ClO-)=c(HClO),k=c(H+)=10-7.54,电离常数Ka的对值lgKa=-7.54,故D正确。
,pH=7.54时,c(ClO-)=c(HClO),k=c(H+)=10-7.54,电离常数Ka的对值lgKa=-7.54,故D正确。
故选B。


科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”表示,如CH3—CH=CH—CH3可简写为![]() ,有机物X的键线式为
,有机物X的键线式为![]() 。下列关于有机物X的说法中正确的是
。下列关于有机物X的说法中正确的是
A. X的含氧官能团是羧基和醚键
B. X的分子式为C7H7O3
C. X因能与酸性KMnO4溶液发生取代反应而褪色
D. 有机物Y是X的同分异构体,能与碳酸氢钠溶液反应且含苯环,则Y的结构有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2mol X和2mol Y充入2L密闭容器中进行反应:X(g)+3Y(g)![]() 2Z(g)+aQ(g)。2min末该反应达到平衡时生成0.8mol Z,测得Q的浓度为0.4
2Z(g)+aQ(g)。2min末该反应达到平衡时生成0.8mol Z,测得Q的浓度为0.4![]() ,则
,则
(1)a的值为______
(2)平衡时X的浓度为_______
(3)平衡时Y的转化率_________
(4)0~2min内Y的反应速率为_______
(5)化学反应平衡时气体X的物质的量分数为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某人设计淀粉利用方案如下图所示:
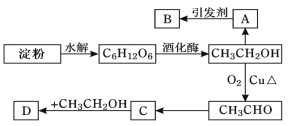
其中:A是乙烯,能催熟水果,B是高分子化合物,D是有水果香味的物质。请回答以下问题:
(1)“C6H12O6”的名称是________,A的电子式为________,C中含有官能团名称_______。
(2) A→B反应类型______________。
(3)写出下列转化的化学方程式
C→D:_____________________,
CH3CH2OH→CH3CHO:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含Fe3+的![]() 和I-的混合溶液中,反应
和I-的混合溶液中,反应![]() 的分解机理及反应进程中的能量变化如下:
的分解机理及反应进程中的能量变化如下:

步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq)
步骤②:![]()
下列有关该反应的说法正确的是
A. 反应速率与Fe3+浓度有关
B. 该反应为吸热反应
C. v(![]() )=v(I-)=v(I2)
)=v(I-)=v(I2)
D. 若不加Fe3+,则正反应的活化能比逆反应的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,作为信息产业和机电工业的重要基础功能材料,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2)为主要原料制备碳酸锰的主要工艺流程如下:

已知:几种金属离子沉淀的pH如下表。
Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.2 | 3.7 | 7.8 | 10. 4 |
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采取的措施不合理的有________。
A.搅拌 B.适当升高温度 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中主要产生的金属阳离子为Fe3+、Mn2+,浸取后的溶液中含有少量Fe2+、Cu2+、Ca2+,则在加入石灰调节溶液的pH从而使铁元素被完全沉淀前,加入适量的软锰矿,其发生反应的离子方程式为____________________,加入石灰调节溶液pH的范围为____________________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要是________(填化学式)和CaF2。若测得滤液中c(F-)为0.01mol·L-1,则滤液中残留c(Ca2+)为________mol·L-1[已知:Ksp(CaF2)=1.46×10-10]。
(4)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是______________________________________。
(5)下图为黄铁矿的质量分数对锰浸出率的影响,仅据图中信息,黄铁矿的质量分数应保持在________%左右。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(23V)被称为“现代工业味精”,可添加在钢铁中,并以钛-铝-钒合金的形式用于航天领域;钒的化合物被广泛用作催化剂、燃料及电池等。我国钒钛磁铁矿储量较大,是世界上产钒大国。请完成下列问题:
(1)钒的基态原子的外围电子排布式为_____。
(2)钒的某种氧化物的晶胞结构如下图1所示,则该氧化物的化学式为________,其熔沸点比下图3(为邻苯二甲酸酐的结构)物质的熔沸点要________(填“高”、“低”或“差不多”)。
(3)V2O5是一种常见的催化剂,在合成硫酸、硝酸、邻苯二甲酸酐、乙烯、丙烯中,均使用五氧化二钒作催化剂。

①五氧化二钒的结构简式如上图2所示,则该结构中含有_______个π键。
②在丙烯(CH3CH=CH2)分子中碳原子的杂化方式分别为__________。
③H、C、N、O四元素,其电负性从大到小的顺序依次为___________________。
④V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。列举与![]() 空间构型相同的一种阳离子:________(填离子符号)。
空间构型相同的一种阳离子:________(填离子符号)。
(4)已知单质钒的晶胞如上图5所示,假设晶胞的边长为d×10—7cm,钒的相对原子质量为M,则密度为__________g·cm-3。(设阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.10mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.20mol/L,则c(SO42-)为( )
A.0.15mol/LB.0.20 mol/LC.0.35 mol/LD.0.40 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应X+3Y![]() 2E+2F,在甲、乙、丙、丁四种不同条件下,分别测得反应速率为甲:υ(X)=0.3mol·L-1·min-1,乙:υ(Y)=0.3 mol·L-1·min-1 ,丙:υ(E)=0.4 mol·L-1·min-1,丁:υ(F)=0.02mol·L-1·s-1,则反应速率最快的是
2E+2F,在甲、乙、丙、丁四种不同条件下,分别测得反应速率为甲:υ(X)=0.3mol·L-1·min-1,乙:υ(Y)=0.3 mol·L-1·min-1 ,丙:υ(E)=0.4 mol·L-1·min-1,丁:υ(F)=0.02mol·L-1·s-1,则反应速率最快的是
A. 甲B. 乙C. 丙D. 丁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com