
(9分)现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图。

(1)a点对应的沉淀为 (填化学式)。
(2)计算原混合液中FeCl3的物质的量浓度为多少?(写出计算过程)
科目:高中化学 来源: 题型:
 现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入80mL 浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.
现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入80mL 浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.| 0.32 |
| n |
| 0.32 |
| n |
查看答案和解析>>
科目:高中化学 来源: 题型:




| b |
| 18 |
| 5n |
| 22.4×9 |
| b |
| 18 |
| b |
| 18 |
| 5n |
| 22.4×9 |
| b |
| 18 |
查看答案和解析>>
科目:高中化学 来源:读想用 高二化学(上) 题型:038
现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1 mol,在此溶液中加入90 mL 4 mol·L-1的NaOH溶液,使其充分反应,设Al3+物质的量与总物质的量的比值为x.
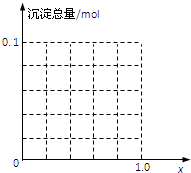
(1)计算溶液中产生的沉淀只有Fe(OH)3时x的取值范围.请在坐标图中作出沉淀总量(mol)随x(0→1)变化的曲线.
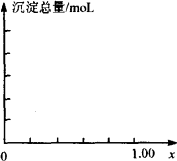
(2)若Fe3+和Al3+物质的量之和为A mol(A为合理数值),其他条件不变时,求沉淀中同时有Fe(OH)3和Al(OH)3的x取值范围和各沉淀的物质的量(用含A、x的式子表示).
查看答案和解析>>
科目:高中化学 来源:2011-2012年海南省海南中学高二下学期期中考试文科化学试卷(带解析) 题型:填空题
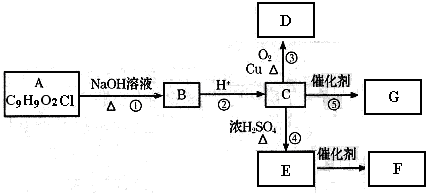
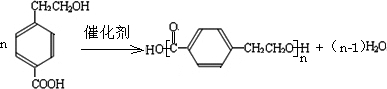
(12分)现有一包AlCl3和FeCl3的混合粉末,欲将其中的Al元素和Fe元素分开,可进行如下操作: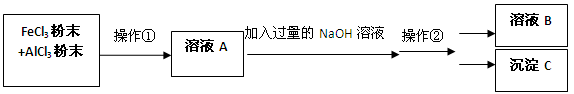
(1) 操作①名称是 ,操作②名称是 (过滤/分液/蒸馏/溶解/结晶);
(2)溶液B是 ,沉淀C是
(3)若往溶液A中滴入KSCN溶液,预计会观察到溶液呈 色;
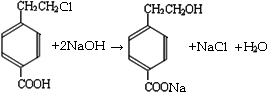
(4)请写出在溶液中,FeCl3和NaOH反应的离子方程式:
查看答案和解析>>
科目:高中化学 来源:2011-2012年海南省高二下学期期中考试文科化学试卷(解析版) 题型:填空题
(12分)现有一包AlCl3和FeCl3的混合粉末,欲将其中的Al元素和Fe元素分开,可进行如下操作:
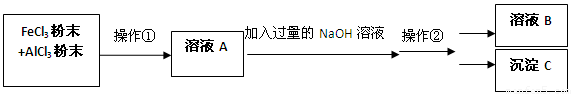
(1) 操作①名称是 ,操作②名称是 (过滤/分液/蒸馏/溶解/结晶);
(2)溶液B是 ,沉淀C是
(3)若往溶液A中滴入KSCN溶液,预计会观察到溶液呈 色;
(4)请写出在溶液中,FeCl3和NaOH反应的离子方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com