

分析 由制备实验流程可知,废旧钢片回收铜并制备绿矾晶体,先清洗后加过氧化氢,发生Cu+H2SO4+H2O2=CuSO4+2H2O,再加过量Fe,发生Fe+CuSO4=FeSO4+Cu,过滤后滤液为B,主要含FeSO4,然后蒸发浓缩、冷却结晶得到晶体.
(1)A中溶解时Cu与过氧化氢、稀硫酸发生氧化还原反应;
(2)碘遇淀粉变蓝,可利用淀粉为指示剂进行滴定,滴定前溶液中的H2O2没有除尽,消耗Na2S2O3标准液的体积偏大;
(3)A.电解时电能转化为化学能,但能量不能完全转化;
B.粗铜接电源正极,阳极失去电子;
C.电解时阳离子向阴极移动;
D.阳极上Ag、Pt、Au 等金属不能失去电子;
E.电解时阳极Al、Zn、Cu失去电子,阴极上铜离子得到电子;
F.阳极减轻的质量为Al、Zn、Cu的质量,而阴极增加的质量为Cu的质量;
(4)从滤液B中制取绿矾晶体用少量冰水洗涤,降低温度防止晶体溶解.
解答 解:由制备实验流程可知,废旧钢片回收铜并制备绿矾晶体,先清洗后加过氧化氢,发生Cu+H2SO4+H2O2=CuSO4+2H2O,再加过量Fe,发生Fe+CuSO4=FeSO4+Cu,过滤后滤液为B,主要含FeSO4,然后蒸发浓缩、冷却结晶得到晶体.
(1)A中溶解时Cu与过氧化氢、稀硫酸发生氧化还原反应,发生的反应为Cu+H2SO4+H2O2=CuSO4+2H2O,故答案为:Cu+H2SO4+H2O2=CuSO4+2H2O;
(2)碘遇淀粉变蓝,可利用淀粉为指示剂进行滴定,滴定终点的现象是溶液由蓝色褪为无色,滴定前溶液中的H2O2没有除尽,消耗Na2S2O3标准液的体积偏大,由电子守恒可知所测定的Cu2+含量将会偏高,
故答案为:淀粉;溶液由蓝色褪为无色;偏高;
(3)A.电解时电能转化为化学能,但电能不能完全转化为化学能,可能部分转化为热能,故A错误;
B.粗铜接电源正极,阳极失去电子,发生氧化反应,故B正确;
C.电解时阳离子向阴极移动,则溶液中Cu2+向阴极移动,故C错误;
D.阳极上Ag、Pt、Au 等金属不能失去电子,形成阳极泥,利用阳极泥可以回收Ag、Pt、Au 等金属,故D正确;
E.电解时阳极Al、Zn、Cu失去电子,阴极上铜离子得到电子,由Zn+CuSO4=ZnSO4+Cu等可知电解后CuSO4溶液浓度减小,故E正确;
F.阳极减轻的质量为Al、Zn、Cu的质量,而阴极增加的质量为Cu的质量,转移相同电子时二者质量不同,故F错误;
故答案为:BDE;
(4)从滤液B中制取绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O 的损耗,
故答案为:降低洗涤过程中FeSO4•7H2O 的损耗.
点评 本题考查制备实验方案的设计及混合物分离提纯,为高频考点,把握制备流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:E>F>C>D | |
| B. | 分子AC2中各原子最外层均满足8电子结构 | |
| C. | 由D、F组成的盐溶液蒸干后可以得到原溶质 | |
| D. | 元素B的最高价氧化物对应的水化物与其氢化物可以反应生成一种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
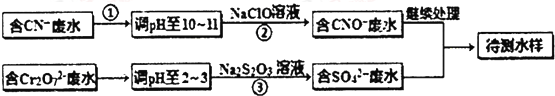
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
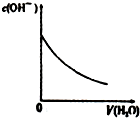 | 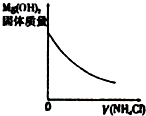 | 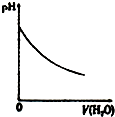 | 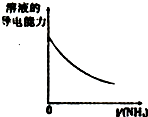 |
| A、盐酸加水稀释 | B、Mg(OH)2悬浊液中滴加NH4Cl溶液 | C、NH4Cl稀溶液加水稀释 | D、NH3通入醋酸溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸、氢氧化钠溶液能导电,所以它们都是电解质 | |
| B. | 电解质溶液通电时,电解质才能发生电离 | |
| C. | 水溶液能导电的化合物不一定是电解质 | |
| D. | 难溶物质肯定不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
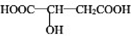 )常用于汽水、糖果的添加剂,
)常用于汽水、糖果的添加剂,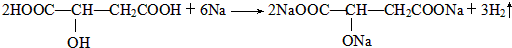 ;
;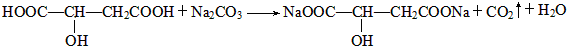
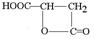 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com