
分析 分别加入等体积、等浓度的硝酸银溶液,均恰好完全反应生成氯化银沉淀,存在NaCl~$\frac{1}{2}$MgCl2~$\frac{1}{3}$AlCl3~AgCl↓,以此来解答.
解答 解:设生成AgCl为1mol,则
由NaCl~$\frac{1}{2}$MgCl2~$\frac{1}{3}$AlCl3~AgCl↓可知,
氯化钠、氯化镁和氯化铝的物质的量分别为1mol、$\frac{1}{2}$mol、$\frac{1}{3}$mol,
结合c=$\frac{n}{V}$可知,
体积之比为1:2:3,三种溶液的物质的量浓度之比为$\frac{1}{1}$:$\frac{\frac{1}{2}}{2}$:$\frac{\frac{1}{3}}{3}$=36:9:4,
故答案为:36:9:4.
点评 本题考查化学反应的计算,为高频考点,把握氯离子守恒为解答的关键,侧重分析与计算能力的考查,注意关系式法的应用,题目难度不大.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
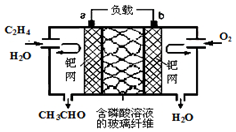 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A. | 该装置能量转化形式是电能转化为化学能 | |
| B. | 负极反应式为:CH2=CH2-2e-+H2O=CH3CHO+2H+ | |
| C. | 每有0.1 mol O2反应,则向负极迁移的H+的物质的量为0.4 mol | |
| D. | 电子移动方向:电极a→磷酸溶液→电极b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
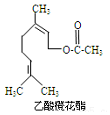 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )| A. | ①②③ | B. | ①②⑤ | C. | ①②⑤⑥ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
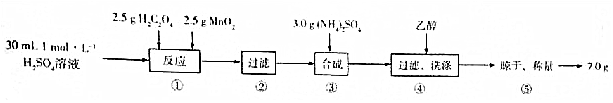
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 12 | C. | 24 | D. | 28 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
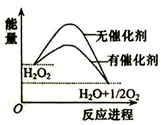
| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | H2O2分解的热化学方程式:H2O2=H2O+O2 △H<0 | |
| D. | 断键吸收的总能量小于成键放出的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com