
| A. | c(H+)随温度的升高而降低 | |
| B. | 35℃时,c(H+)>c(OH-) | |
| C. | 溶液:pH(35℃)>pH(25℃) | |
| D. | 35℃时已电离的水的浓度约为2×10-7mol/L |
分析 水的电离过程为H2O?H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14,说明升高温度促进水电离,升高温度后水中c(H+)增大,其pH减小,但仍然存在c(H+)=c(OH-),即纯水无论在什么温度下均显中性,据此分析解答.
解答 解:水的电离过程为H2O?H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14,说明升高温度促进水电离,升高温度后水中c(H+)增大,其pH减小,但仍然存在c(H+)=c(OH-),即纯水无论在什么温度下均显中性.
A.升高温度促进水电离,则c(H+)随温度的升高而增大,故A错误;
B.升高温度促进水电离,但水中仍然存在c(H+)=c(OH-),即水永远呈中性,故B错误;
C.升高温度促进水电离,则c(H+)随温度的升高而增大,所以温度越高,水的pH越小,即溶液:pH(35℃)<pH(25℃),故C错误;
D.Kw(35℃)=2.1×10-14,35℃时已电离的水的浓度=$\sqrt{2.1×1{0}^{-14}}$=1.45×10-7 mol/L,故D正确.
故选D.
点评 本题考查水的电离,侧重考查学生获取信息、分析学习能力,知道离子积常数与温度的关系是解本题关键,注意:无论水的电离程度多大,水不能变为酸或碱,仍然呈中性,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成与氮的氧化物无关 | |
| B. | 钙、铁、碘都是人体内必需的微量元素 | |
| C. | 白酒中混有少量塑化剂,可通过过滤除去 | |
| D. | 登高山时防晒是为了防止强紫外线引起皮肤蛋白质被灼伤变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
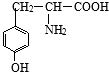 有一种结构简式如图的有机物,请回答下列问题:
有一种结构简式如图的有机物,请回答下列问题: +2NaOH→
+2NaOH→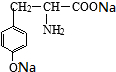 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 mol | B. | 4 mol | C. | 5 mol | D. | 6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量不同密度的C2H4和CO | B. | 同温度同体积的C2H6和NO2 | ||
| C. | 同温度同密度的CO2和N2 | D. | 同体积同压强的N2和C2H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com